Tento článek poskytuje detailní rozbor amfetaminu, stimulantu centrální nervové soustavy (CNS), který je v medicíně hojně užíván na léčbu poruchy pozornosti/hyperaktivity (ADD/ADHD), narkolepsie a obezity. Kromě lékařského využití se však tento stimulant rovněž těší velké popularitě mezi rekreačními uživateli, kteří ho vyhledávají pro své silné stimulační a euforické účinky, které jsou v mnoha ohledech podobné účinkům příbuzného metamfetaminu (pervitinu).
Pokud tedy hledáte odpovědi na otázky jako, co to vlastně amfetamin je? Kdy a kým byl objeven? Jak účinkuje v CNS? Jaké duševní stavy vyvolává? Jak se dávkuje? A jak ho brát bezpečně?
Tak veškeré odpovědi na tyto otázky naleznete v článku níže, jehož obsah je podložený empirickými důkazy z široké škály vědeckých studií.
Amfetamin
Obsah článku
- Úvod
- Chemický přehled I
- Chemický přehled II – Bližší popis
- Chemický přehled III – Syntéza
- Historie
- Nové tisíciletí až současnost
- Mechanismus účinků I – Přehled neurotransmiterů a jejich drah v mozku
- Dopamin
- Noradrenalin
- Serotonin
- Endorfiny
- Mechanismus účinků II – Terminologie
- Mechanismus účinků III – Nitrobuněčný a mezi-synaptický mechanismus
- Mechanismus účinků IV – Sekundární mechanismus
- Farmakokinetika
- Metabolizace I – Metabolický proces amfetaminu
- Metabolizace II – Přehled farmakologicky aktivních metabolitů
- Hydroxyamfetamin
- Parahydroxynorefedrin
- Norefedrin
- Bezpečné užívání I – Způsob užití
- Rizika různých způsobů užití
- Dávkování
- Přibližné dávkování ostatních způsobů užití
- Časový průběh
- Účinky
- Psychické účinky
- Fyzické účinky
- Vizuální účinky
- Vizuální drifting
- Změna vnímaného vizuálního jasu
- Vizuální tracery
- Bezpečné užívání II – Základní principy bezpečného užívání
- Interakce s dalšími látkami
- Tabulka interakcí
- Bezpečné užívání III – Symptomy předávkování
- Tabulka symptomů předávkování
- Bezpečné užívání IV – Léčba předávkování – první pomoc
- Léčba v nemocnici – Screening
- Léčba v nemocnici – Léčba
- Reference
Úvod
Amfetamin (slangově speed) je stimulant centrální a periferní sympatické nervové soustavy, který je v medicíně užíván jako lék na celou řadu diagnóz od narkolepsie až po poruchu pozornosti a hyperaktivity (Attention Deficit Hyperactivity Disorder – ADHD) (Heal et al., 2013; Martin & Le, 2021; NCBI (a), 2022; Sharbaf et al., 2022).
Díky svým centrálně-stimulačním vlastnostem, které zapříčiňují zvýšenou schopnost analytického myšlení, pozornosti, motivace a zlepšení krátkodobé paměti, je však také užíván jako nootropikum, tedy látka, která krátkodobě navyšuje kognitivní kapacitu jedince. V této roli si našel uplatnění, především mezi vysokoškolskými studenty a dále pak lidmi, kteří vykonávají kognitivně náročné profese (např. vrcholový management nebo burzovní obchodníci) (Ilieva & Farah, 2013; Bagot & Karimer, 2014; Ilieva et al., 2015; Spencer et al., 2015).
Vzhledem k tomu, že amfetamin rovněž navyšuje aktivitu periferní sympatické nervové soustavy, tak je také, do značné míry, vyhledáván i sportovci, kteří ho užívají za účelem navýšení své fyzické kapacity. V rámci sportu (např. kulturistika) je tato látka také užívána jako anorektikum potlačující chuť k jídlu (Angooran et al., 2012; Lakhan & Kirchgessner, 2012; Liddle & Connor, 2013).
Ve vyšších dávkách má amfetamin tendenci vyvolávat pocit dobré nálady až euforie, díky čemuž je také populární jakožto rekreační droga. Svými účinky je velice podobný kokainu, avšak oproti kokainu, je podstatně silnější na dávku a také disponuje delším trváním účinků, které se u orálního užití pohybují v rozmezí 6 až 8 hodin (pro srovnání, délka trvání účinků kokainu se pohybuje v rozmezí 30 až 120 minut v závislosti na metodě užití) (Drug Bank – Amphetamine, 2022; Drug bank – Cocaine, 2022; EMCDDA (a), 2022; EMCDDA (b), 2022; Richards & Laurin, 2022). V Česku není amfetamin natolik rozšířen a na místo toho je zde populárnější metamfetamin (pervitin), který se od samotného amfetaminu liší pouze přidanou methylovou skupinou. Jedná se tedy o methylovaný amfetamin (EMCDDA ©, 2022). Přidaná methylová skupiny umožňuje snadnější průchod mozkovou bariérou, což razantně zvyšuje dávkovou potenci. Metamfetamin má také delší dobu trvání účinků, která se pohybuje v rozmezí 8 až 12 hodin. Důvodem je zde skutečnost, že je postupně metabolizován játry na samotný amfetamin. I přes tyto rozdíly jsou však hlavní psychofyziologické účinky metamfetaminu prakticky k nerozeznání od účinků amfetaminu, tedy až na to, že jsou o něco intenzivnější (EMCDDA (d), 2022).
Chemický přehled

Základní přehled:
Látková kategorie
Stimulant centrální nervové soustavy (CNS)
Druh chemického zařazení
Fenylethylamin
Systematická název
1-phenylpropan-2-amin
Sumární vzorec
C9H13N
Molární hmotnost
135.21 g/mol
Vstřebatelnost (orální)
75 %
Délka účinků
6 h–12 h
Optické enantiomery
d-amfetamin / l-amfetamin
Biologický poločas rozpadu
d-amfetamin 9 h–11 h / l-amfetamin 11 h–14 h
Popis molekulární struktury
Aminová (NH2) a methylová (CH3) skupina napojená na fenylovou skupinu.
Bod varu:
d/l amfetamin sulfát: 203 °C–204 °C / 1 atmosféra
Bližší popis
Z chemického hlediska lze amfetamin kategorizovat jako homolog či substitut fenylethylaminu. Jedná se tedy o látku, která je strukturálně odvozena od fenylethylaminu. Jak je patrné z obrázku, tak to jediné, v čem se molekula amfetaminu odlišuje od samotného fenylethylaminu je přidaná methylová (CH3) skupina na alfa pozici aminového (NH2) řetězce. Díky této skutečnosti je amfetamin občasně také nazýván jako α-methylfenylethylamin (NCBI, ab, 2022). Za zmínku zde stojí skutečnost, že jak amfetamin, tak i chemicky příbuzný fenylethylamin posloužily jako stavební kámen mnoha syntetických psychotropních látek, které disponují jak stimulačními (pervitin), tak i empatogenními (MDMA – slangově extáze) či psychedelickými účinky (DOx – série psychedelických amfetaminů; 2Cx – série psychedelických fenylethylaminů) (EMCDDA, 2022).


Molekula amfetaminu disponuje dvěma optickými enantiomery a sice pravotočivým dextro-amfetaminem a levotočivým levo-amfetaminem. Amfetamin je tedy molekulárně uspořádán do dvou zrcadlových odrazů, které nelze současně ztotožnit (Martin & Le, 2021). Oba zmíněné optické enantiomery mají poněkud rozdílné farmakologické vlastnosti (Lewin et al., 2011). Zatímco d-amfetamin má silnější centrálně stimulační účinky, tak l-amfetamin má pro změnu silnější účinky periferně stimulační. V medicíně je užíván jak racemický mix obou enantiomerů v poměru 1:1 (Adderall), tak i samotný pravotočivý d-amfetamin (Dexedrine), který, na dávku, disponuje tři až čtyřikrát silnějšími centrálně stimulačními účinky ve srovnání s l-amfetamin (Lewin et al., 2011; Martin & Le, 2021). Byť lze syntetizovat pouze jeden ze dvou zmíněných enantiomerů, tak v rekreačních podmínkách se nejčastěji užívá racemický mix. Důvodem je zde snadnější postup syntézy (Allen & Ely, 2011).


V čisté podobě je amfetamin bezbarvou, těkavou, a olejovitou látkou s aminovou vůní a štiplavou chutí. V této podobě je rozpustný pouze v organických rozpouštědlech (NCBI, a, 2022). Volná báze amfetaminu se zpravidla mísí s dalšími látkami, aby vznikla pevná sůl. Ku příkladu k tvorbě sulfátu amfetaminu je zapotřebí, nejdříve volnou bázi rozpustit v organickém rozpouštědle a poté přidat kyselinu sírovou. Výsledkem chemické reakce je poté tvorba krystalického amfetaminu sulfátu (UNODC, 2006). Kromě zmíněného sulfátu lze amfetamin připravit v mnoha jiných pevných solích, včetně sulfátu hydrochloridu, adipátu, aspartátu, fosfátu, sacharátu a tanátu (NCBI, a, 2022).

Jak v medicíně, tak i v rekreačních podmínkách je nejrozšířenější klasický amfetamin sulfát či případně hydrochlorid. V této podobě je amfetamin již rozpustný ve vodě ale také i v organických rozpouštědlech (EMCDDA, 2022). Pevná sůl amfetaminu má podobu bílých až průhledných krystalů či také bílého prášku. Na první pohled je prakticky k nerozeznání od krystalického nebo práškového metamfetaminu (pervitin). Ten je však ve srovnání s amfetaminem podstatně potentnější látkou (EMCDDA, 2022). Právě díky této podobnosti může dojít k nechtěné záměně s fatálními následky. Proto je vždy vhodné si látku testovat reakční kapalinou, která dle zbarvení poukáže na přítomnost konkrétní látky ve vzorku (reakční kapaliny lze koupit zde: https://www.protestkit.eu).


Lékařský amfetamin má zpravidla podobu pilulek či tobolek. Obsah amfetaminu se může lišit v závislosti na typu tabletky/tobolky, výrobci a obchodní značce (Adderall, Dexedrine, Vyvanse). V lékařském kontextu se běžně užívají tři druhy tabletek/tobolek; IR (Immediate Release) – okamžité uvolnění, SR (Sustained Release) – postupné uvolňování a EX/ER (Extended Release) – prodloužené uvolňování (Stein et al., 2011). Tabletky verze IR se v dnešní době již tolik nepoužívají. Hlavním důvodem je kratší délka účinků ve srovnání s SR/ER tabletkami, kvůli které musí pacienti brát více jak jednu dávku amfetaminu denně. Dalším důvodem je pak rekreační užívání IR tabletek. Díky tomu, že je u SR/ER tabletek amfetamin vypouštěn do těla postupně, tak se snižuje pravděpodobnost vzniku silné euforie, čímž se snižuje rekreační potenciál těchto tabletek/tobolek (Stein et al., 2011; Martin & Le, 2021).



Ilegálně vyrobený amfetamin má nejčastěji formu bílého prášku nebo krystalů. Na černém trhu se občasně také prodává v tabletách, které mohou být zdobeny různými logy, podobně jako je tomu u tabletek MDMA (extáze) (EMCDDA, 2022). V některých případech je amfetamin záměrně přidáván do tabletek extáze jako přídavek, a to kvůli levnější a jednodušší syntéze (Parrott, 2004). Takovéto tabletky mohou být pro uživatele extrémně nebezpečné, obzvláště pokud mají vysoký obsah obou látek. Výzkum zde totiž naznačuje, že u této kombinace hrozí negativní metabolická interakce, která může vyústit v nechtěné předávkování (da Silva et al., 2013). Přesně kvůli tomu, je zde znovu vhodné použit reakční kapalinu a otestovat si obsah tabletky. Konkrétní důvod, proč k této negativní metabolické interakci dochází je pak blíže rozepsán v sekci zabývající se metabolizací amfetaminu. Když se nyní zpětně přesuneme k různým formám amfetaminu, tak poslední formou, s kterou se lze, na černém trhu setkat, je tak zvaná pasta, kterou je třeba nejdříve vysušit, aby z ní vznikl moučkovitý prášek vhodný k aplikaci.


Syntéza
Syntéza amfetaminu je proslulá svojí jednoduchostí, díky které, jsou tuto látku schopni syntetizovat i relativně nezkušení amatérští chemici bez odborného vzdělání. Právě díky této skutečnosti je amfetamin na černém trhu natolik rozšířen (Chambers et al., 2018).
Nyní se v rychlosti podíváme na jeden z nejpopulárnějších způsobů syntézy, který nese název Leuckartova metoda (Pollard & Young, 1951; UNODC, 2006, Chambers et al., 2018; EMCDDA, 2022). Zcela pochopitelně zde nebudu zacházet do přílišných detailů, jednak kvůli zákonné rovině a zadruhé kvůli riziku úrazu nebo otravy.
Leuckartova metoda je postavena na principu Leuckartovi chemické reakce, která převádí aldehydy nebo ketony na aminy redukční aminací za přítomnosti tepla (Pollard & Young, 1951; Chambers et al., 2018). Výchozím prekurzorem u této syntetizační metody amfetaminu bývá nejčastěji fenylaceton. V prvním kroku této metody dochází k reakci mezi fenylacetonem a formamidem s využitím redukčního činidla, kterým je buď samotný formamid nebo kyselina mravenčí. Výsledkem této reakce je tvorba N-formylamfetaminu (také amfetamin formamid). Tento meziprodukt se poté hydrolyzuje pomocí kyseliny chlorovodíkové a dále se alkalizuje. Následně je třeba provést extrakci pomocí organického rozpouštědla, koncentraci a destilaci, čímž se získá racemická volná báze amfetaminu (UNODC, 2006; EMCDDA, 2022). Obrázek níže znázorňuje grafickou reprezentaci jednotlivých kroků této syntetizační metody.

Kromě zmíněné Leuckartovi metody existují i další populární metody syntézy amfetaminu. Obrázek níže znázorňuje syntetizační proceduru, která vede k tvorbě čistého pravotočivého enantiomeru d-amfetaminu (UNODC, 2006; Allen & Ely, 2009; EMCDDA, 2022).

Historie
Historie amfetaminu se začala psát před 5000 lety ve starověké Číně, kdy se v této zemi začalo rozšiřovat rekreační a lékařské užívání Chvojníku, který obsahuje alkaloid zvaný efedrin. Podobně jako samotný amfetamin, oplývá tento alkaloid stimulačními účinky. Ty jsou však ve srovnání s amfetaminem o něco mírnější (Chambers et al., 2018; Morelli & Tognotti, 2021).

O téměř 5000 let později, konkrétně v druhé polovině 19. století, se Japonci začali zajímat o potenciální využití efedrinu v medicíně. Brzo však zjistili, že užívání samotného Chvojníku je velice neefektivní, kvůli relativně nízkému obsahu efedrinu. Proto se tedy rozhodli efedrin s Chvojníku izolovat. Toto se jim povedlo v roce 1885 (Morelli & Tognotti, 2021). Nicméně brzo zjistili, že masivní produkce efedrinu extrakcí s Chvojníku je vcelku dost neefektivní, a to jak kvůli nízkému obsahu alkaloidu, tak i relativně vysoké ceně izolačního procesu. Kvůli tomu se rozhodli syntetizovat chemický analog odvozený od efedrinu, který by bylo možně produkovat levně a ve velkém množství (Grobler et al., 2011; Morelli & Tognotti, 2021).

Současně s Japonci se o lékařské využití efedrinu zajímaly i Němci. Podobně jako Japonci se nakonec rozhodli vytvořit chemický analog efedrinu, který by byl vhodný pro levnou a hromadnou produkci. Toho se jim nakonec povedlo docílit v roce 1887 kdy se Lazaru Edeleanu, původně rumunskému rodákovi, který v té době pracoval v Německu jako chemik, poprvé podařilo syntetizovat racemický amfetamin (Chambers et al., 2018; Morelli & Tognotti, 2021). Lazaru pojmenoval tuto nově syntetizovanou látku jako phenylisopropylamin (Edeleano 1887; Chambers et al., 2018).
I přes tuto úspěšnou syntézu, upadl amfetamin po velice krátké době v zapomnění a trvalo další tři desetiletí, než se zjistilo, že oplývá stimulačními účinky.

V roce 1893 slavili úspěch syntézy nového analogu efedrinu i Japonci, jelikož se jim podařilo z efedrinu syntetizovat metamfetamin (pervitin). Syntézu provedl japonský chemik zvaný Nagai Nagayoshi (Grobler et al., 2011).

V roce 1929 byl amfetamin znovu syntetizován americkým chemikem a farmakologem Gordonem Allesem, který se snažil najít látku s podobnými účinky jako efedrin. Po úspěšné syntéze, na sobě Alles látku vyzkoušel a v ten samí rok vydal výzkumnou zprávu, která poprvé popsala psychofyziologické účinky amfetaminu. V roce 1932, si nechal Alles patentovat několik variant amfetaminových solí jako lék na astma (Rasmussen, 2006; Rasmussen, 2008; Rasmussen, 2015).
V roce 1933 se o amfetamin začala zajímat Filadelfská firma Smith, Kline & French (SKF), která si nechala vystavit patent na volnou bázi racemického amfetaminu ve spreji na astma, který nesl obchodní název Benzedrine. Nedlouho poté se v USA začal Benzedrine prodávat jako volně dostupný dekongestant (lék na zduřelé nosní sliznice) a v této podobě zůstal volně prodejný dalších 25 let (Rasmussen, 2006; Rasmussen, 2008; Rasmussen, 2015).


V roce 1934 předal Gordon Alles veškeré své patenty firmě SKF, která poté začala vyrábět amfetamin sulfát v tabletách pod stejnou obchodní značkou jakou měl jejich inhalátor. Tyto tabletky se pak od roku 1937 začali v USA používat na celou řadu lékařských diagnóz od narkolepsie, přes Parkinsonovu chorobu až po mírnou formu klinické deprese (Rasmussen, 2006; Rasmussen, 2008; Rasmussen, 2015).
Během druhé světové války byl amfetamin s metamfetaminem hojně užíván oběma stranami konfliktu. Zcela pochopitelně byli tyto látky užívány především pro své silné stimulační účinky, které vojákům umožňovaly téměř nepřetržité vedení bojových operací bez nutnosti odpočinku. Zatímco Němci a Japonci holdovali metamfetaminu, který v Německu nesl obchodní název Pervitin, tak spojenci v čele s Američany a Brity preferovaly tabletky Benzedrinu obsahující amfetamin (Rasmussen, 2008; Defalque & Amos, 2011; Rasmussen, 2011; Rasmussen, 2015; Jenkins, 2022).

Kromě této skutečnosti, zde ještě byl rozdíl v distribuci těchto látek konkrétním vojenským jednotkám, jelikož Němci do dubna roku 1941, přidělovali dávky Pervitinu prakticky všem vojenským uskupením od tankistů, přes pěchotu až po letce, zatímco spojenci přidělovali Benzedrine výhradně letcům a speciálním jednotkám. Naproti tomu Japonci přidělovali Pervitin pozemním vojskům a letcům (Rasmussen, 2008; Defalque & Amos, 2011; Rasmussen, 2011; Rasmussen, 2015; Jenkins, 2022).

Relativně široká distribuce Pervitinu napříč různými jednotkami Německé armády stála, do určité míry, za úspěchem blitzkriegu v průběhu prvních let války, jelikož se takto německým divizím dařilo zabrat stovky kilometrů čtverečních nepřátelského území, bez nutnosti odpočinku. Zcela logicky si však časté užívání Pervitinu německými jednotkami začalo vybírat svou daň a netrvalo dlouho než se v roce 1941 začaly objevovat zprávy z řad vojenských lékařů, které poukazovali na vznik psychické závislosti, stimulační anorexie, spánkové deprivace, a toxické psychózy. Proto se tedy v dubnu roku 1941, německé velení rozhodlo přestat s armádní distribucí Pervitinu. To však ale nezabránilo jeho občasnému neoficiálnímu užívání, které pokračovalo až do konce války. Za zmínku stojí i to, že byl Pervitin během válečného období volně dostupný i pro civilní trh, na kterém se dokonce prodávali i energetické čokoládové pralinky (zvané Scho-Ka-Kola) obsahující tuto látku, které se těšili velké oblibě, zejména u žen v domácnosti. Pervitin a příbuzný amfetamin, byl do konce užíván i samotným führerem Adolfem Hitlerem, který ho od roku 1942 užíval prakticky na denní bázi v podobě tzv. Vitamultinu, který obsahoval vitamíny a metamfetamin hydrochlorid. Tento bizarní látkový koktejl, mu téměř každé ráno administroval nitrožilní cestou, jeho osobní lékař Theodor Morell, který byl svými kolegy považován za nekompetentního šarlatána. Ke sklonku války začal Hitler trpět klidovým třesem končetin (především rukou), což je jeden s prvotních symptomů počínající Parkinsonovi choroby. Vzhledem k tomu, že dnes víme, že časté, nadměrné a dlouhodobé užívání pervitinu vede k mozkové toxicitě, kdy doslova dochází k úmrtí dopaminergních (a i serotoninergních) neuronů, tak se dá usuzovat, že u Hitlera došlo k rozvoji Parkinsonovi choroby, která je charakterizována postupným úbytkem dopaminu v mozku v důsledku degradace a úmrtí dopaminergních neuronů (Rasmussen, 2008; Defalque & Amos, 2011; Rasmussen, 2011; Rasmussen, 2015; Jenkins, 2022).

Japonci užívání Pervitinu, až do konce války, nikterak neregulovali a dokonce ho, kromě armády, pravidelně distribuovaly mezi civilní dělníky pracující v továrnách na výrobu zbraní. Navíc byl v tehdejším Japonsku metamfetamin volně dostupný i pro civilní trh pod obchodní značkou Philopon. Spojenci se, naproti tomu, snažili užívání Benzedrinu regulovat nižším přídělem a vydáváním bezpečnostní směrnice k jeho užívání. V praxi se však ukázalo, že na tyto směrnice vojáci nebrali příliš velké ohledy. Například vojenský průzkum z roku 1945 ukázal, že až 15 % bojových letců užívalo tabletky Benzedrinu kdykoli měli pocit, že ho potřebují. Během válečných let, zůstal navíc Benzedrine volně dostupný jak pro americký, tak i britský civilní trh a jeho spotřeba, především pak mezi americkými civilisty, prudce rostla (Tamura, 1989; Rasmussen, 2008; Defalque & Amos, 2011; Rasmussen, 2011; Rasmussen, 2015; Jenkins, 2022).

Konečně v roce 1959, začal být Benzedrine v USA vydáván pouze na lékařský předpis. Přesto však bylo velice snadné si ho, v té době, obstarat nelegitimní cestou. Navíc, byl předepisován na velice širokou škálu lékařských diagnóz, díky čemuž bylo užívání amfetaminu v USA i nadále velice rozšířené (Gal, 1982; Rasmussen, 2008; Rasmussen, 2015).
Mezi léty 1951 až 1954, zakázalo japonské ministerstvo zdravotnictví veškerou výrobu a prodej amfetaminu a metamfetaminu, kvůli zneužívání. Tímto krokem si však japonská vláda příliš nepomohla, protože s výrobou obou látek začala japonská Yakuza (Tamura, 1989; Sato, 2008; Edström, 2015).
V 60. letech 20. století se stal amfetamin velice populární i ve Velké Británii. Kromě jeho obliby mezi lékaři, se stal oblíbenou rekreační drogou Modernistů (Mods subculture), u kterých nahradil alkohol v roli hlavní společenské drogy a byl s touto subkulturou spojován podobně jako je marihuana spojována s hippies (Wilson, 2008).

Následující tři dekády, se postupně, začala zpřísňovat globální regulace amfetaminu. Například v roce 1965 byl v USA zakázán prodej inhalátorů Benzedrine, kvůli reportovanému zneužívání. Poté v roce 1971, byl amfetamin v USA zařazen do II. kategorie zakázaných návykových látek, a tak jeho výroba, distribuce či prodej byl legislativně vázán pouze na lékařské a vědecké využití. V ten samí rok, zařadila amfetamin na seznam zakázaných látek II. kategorie i Organizace Spojených Národů (OSN), přičemž do roku 1990 podepsalo tuto rezoluci na 180 členských států OSN (Rasmussen, 2008; Jenkins, 2022; OSN, 2022).
I přes zařazení amfetaminu na seznam přísně regulovaných látek, nedošlo ke značnému globálnímu poklesu jeho užívání a na místo toho se jeho popularita a spotřeba v průběhu 90. let 20. století nadále zvyšovala, a to až do počátku nového tisíciletí (OSN, 2001). Obrázek níže znázorňuje spotřebu lékařského amfetaminu a methylfenidátu (stimulant CNS, užívaný primárně na léčbu poruchy pozornosti a hyperaktivity) v USA, mezi léty 1969 až 2004.

Nové tisíciletí až současnost
Počátkem nového tisíciletí, došlo k dalšímu globálnímu nárůstu spotřeby amfetaminu a tento trend pokračoval až do roku 2010, kdy amfetamin užilo alespoň jednou v životě 52.5 milionů lidí (OSN, 2001; Statista, 2022).
Naproti tomu data evropského monitorovacího centra drogové problematiky z roku 2012 ukázala, že policie všech tehdejších členských států EU zabavila 5.9 tun ilegálně vyrobeného amfetaminu. Tento zásah do černého trhu, nejspíš přispěl k mírnějšímu poklesu spotřeby ilegálního amfetaminu na evropském černém trhu. Nicméně, celková globální spotřeba se mezi léty 2012 až 2014 znovu zvýšila a to s 54.8 milionů uživatelů v roce 2012 na 55.9 milionů v roce 2014 (EMCDDA, 2014; OSN, 2014; Statista, 2022).
Mezi léty 2014 až 2016 vzrostl počet evropských uživatelů amfetaminu s 2.8 milionů na 3.45 milionů. S ohledem na růst tohoto trendu se dá usuzovat, že zde hrála roli jak vysoká nabídka amfetaminu na černém trhu, tak i jeho relativně nízká pouliční cena, která měla v roce 2014 rozpětí mezi 6 až 38 eury za gram (EMCDDA, 2014; 2018).
Dále pak data z národního průzkumu užívání drog, který proběhl v USA, ukázala, že v roce 2015 užívalo amfetamin na lékařský předpis 1.8% americké populace, tedy něco kolem 4.8 milionů Američanů (AAC, 2022).
Další statistiky evropského monitorovacího drogového centra z roku 2018 ukázala, že amfetamin a jeho chemicky příbuzný metamfetamin užilo alespoň jednou za život 11,9 milionů Evropanů ve věku 15 až 64 let a dalších 1,7 milionů Evropanů pak užilo jednu ze dvou jmenovaných látek alespoň jednou v předešlém roce (EMCDDA, 2018).
Poslední dostupné statistiky poukázali na to, že v roce 2020, činil počet globálních uživatelů amfetaminu 34 milionů lidí (Statista, 2022).
Dle dostupných dat se největší ilegální trhy s amfetaminy nachází v Evropě, Asii a Severní Americe, přičemž v rámci Evropy je největším ilegálním producentem amfetaminu a příbuzného metamfetaminu Holandsko. Kromě Holandska jsou významnými producenty těchto látek i Belgie a Česká republika (EMCDDA, 2022). Zatímco v Evropě je populárnější amfetamin, tak v Asii je populárnější metamfetamin (OSN, 2014).
Pokud jde o ilegální trh s amfetaminy v severní Americe, tak tomu dominuje metamfetamin, který je do USA často importován mexickými kartely s Mexika. V poslední době však dochází ke zvýšené produkci této látky i na samotném území USA (OSN, 2014).
Zajímavostí na závěr je pak skutečnost, že v roce 2016 byly amfetamin s metamfetaminem, v globálním měřítku, shledány jako třetí nejužívanější ilegální návykovou látkou po marihuaně a opiátech/opioidech, přičemž čtvrté místo náleželo MDMA (extáze) a páté kokainu (OSN, 2018).
Mechanismus účinků I
Přehled neurotransmiterů a jejich drah v mozku
V této sekci si krok po kroku představíme konkrétní farmakologické mechanismy, kterými amfetamin produkuje své psychofyziologické účinky. Nejdříve se však podíváme na přehled čtyř neurotransmiterů, konkrétně dopaminu, noradrenalinu, serotoninu, a beta-endorfinů, které v rámci centrální a periferní nervové soustavy plní mnoho důležitých funkcí, a které se, při užití amfetaminu, přímo podílí na samotné produkci psychotropních a fyziologických účinků.
Dopamin
Dopamin (3,4-Dihydroxy-fenylethylamin), je jedním z hlavních neurotransmiterů mozku, který plní hned několik důležitých rolí, včetně regulace pocitů odměny, exekutivních dovedností, motivace, pozornosti, asociativního učení a motoriky (Liu & Kaeser, 2019; Wise & Robble, 2020; Bhatia et al., 2022; Sonne et al., 2022).

Dopamin je v rámci CNS produkován ve střední oblasti mozku, a to konkrétně ve Ventrální tegmentální oblasti (Ventral tegmental area) a Substantia Nigře (Substantia Nigra) (Olguín et al., 2015; Sonne et al., 2021). Kromě samotného mozku je také produkován, společně s adrenalinem, v nadledvinkách a mimo CNS plní roli hormonu, který se podílí na regulaci správné funkce kardiovaskulární soustavy, imunitního systému, ledvin a slinivky břišní (Seeman, 2009). Dopamin tělu dále slouží jako chemický prekurzor, s kterého si vyrábí neurotransmiter noradrenalin a hormon adrenalin (Snyder, 2011; Olguín et al., 2015; Sonne et al., 2022).

Dopamin je tělem produkován konverzí esenciálních a neesenciálních aminokyselin jako je fenylalanin a tyrosin, přičemž obě dvě aminokyseliny jsou v hojné míře k nalezení v potravinách bohatých na bílkoviny (Snyder, 2011; Hou & Wu, 2017; Lopez & Mohiuddin, 2022; Sonne et al., 2022). Za zmínku stojí skutečnost, že samotný dopamin je k nalezení i v některých jídlech, včetně mléčných výrobků. Bohužel, konzumací těchto jídel dopamin do mozku nedostanete, protože není schopný penetrovat mozkovou bariéru, a proto aby vykonával roli neurotransmiteru musí být syntetizován samotnými neurony (NCCCC, 2006; Briguglio et al., 2018).
Níže se můžete podívat na proces syntézy dopaminu z fenylalaninu a tyrosinu, na kterém se podílí enzymy zvané fenylalaninhydroxyláza, tyrosinhydroxyláza a dekarboxyláza aromatických aminokyselin.

V rámci CNS má tento neurotransmiter primárně excitační účinky, tedy zvyšuje neurální aktivitu. Dalo by se tedy říct, že dopamin plní roli přirozeně se vyskytujícího stimulantu mozku, který probouzí mozek do aktivního stavu. Nicméně, role dopaminu není omezena pouze na excitační aktivitu, jelikož v některých případech plní i roli inhibiční, tedy v těchto případech mozkovou aktivitu naopak utlumuje. Třetí rolí dopaminu je pak neuromodulace, díky které může ovlivňovat aktivitu jiných neurotransmiterů (Avery & Krichmar, 2017; Wise & Robble, 2020).
To, jakou ze tří zmíněných rolí dopamin v danou chvíli plní, závisí na oblasti mozku, v které se v daném okamžiku vyskytuje a typu receptoru na který se v daný okamžik napojí (Wise & Robble, 2020).
Dopamin je často milně nazýván chemikálií štěstí, která stojí za produkcí pocitů intenzivní slasti a euforie. Byť role dopaminu v rámci CNS zahrnuje i regulaci pocitů odměny, tak jeho zvýšená aktivita po užití drogy jako amfetamin nevede k produkci pocitů euforie a intenzivní slasti, ale na místo toho signalizuje mozku, že užití amfetaminu vede k příjemnému duševnímu stavu (Berridge & Robinson, 2016; Volkow et al., 2016). Tedy jinak řečeno, nám zde dopamin plní roli učitele, který nás učí různé formy asociativního učení, v tomto případě; užití amfetaminu = příjemný duševní stav jako je euforie.
Dalším následkem zvýšené dopaminergní aktivity při užití amfetaminu a návykových látek obecně, je pak přiřazení vysoké hodnoty a význačnosti k pocitu odměny (euforie), kterou droga vyvolává. Důvodem proč v tomto případě mozek přiřadí vysokou hodnotu k odměně je prostý. Návykové látky mají totiž, v mnoha případech, tendenci zvyšovat hladinu dopaminu více nežli naturální odměny typu sex, sport, či jídlo. (Berridge & Robinson, 2016; Volkow et al., 2016).
Kromě asociativního učení a přiřazování hodnoty ke konkrétní odměně, se dopamin také podílí na produkci motivace vyhledávat podněty, jejichž konzumace vede k pocitu odměny. Mezi takové podměty patří i zmíněné jídlo při jehož konzumaci se nám v mozku vyplaví určité množství dopaminu, které zaručí, že budeme do budoucna motivováni ho vyhledávat a konzumovat. Úplně stejným způsobem pak vzniká i patologická motivace vyhledávat a konzumovat drogu, což je v zásadě jeden z hlavních znaků psychické závislosti na droze (Berridge & Robinson, 2016; Volkow et al., 2016; Morales & Berridge, 2020).
Dopamin vykonává všechny tyto role v rámci dopaminergní dráhy mozku, která se dělí na tři sekce; Nigrostriatální (zelená), Mezolimbickou (červená) a Mezokortickou (modrá). Návykové látky jako amfetamin ovlivňují primárně mezokortikolimbické sekce dopaminergní dráhy (Arias-Carrión et al., 2010; Berridge & Robinson, 2016; Volkow et al., 2016). Dopaminergní dráha se také nachází v těsné blízkosti ostatních důležitých drah mozku, mezi, které patří i ta noradrenergní a serotoninergní. Navíc, jak již bylo zmíněno dříve, tak dopamin rovněž plní roli neuromodulační. Právě díky této skutečnosti má změna aktivity dopaminergní dráhy významný vliv na aktivitu drah ostatních, a to včetně noradrenergní, serotoninergní, glutamatergní, opioidní a cholinergní (Avery & Krichmar, 2017; Wise & Robble, 2020).
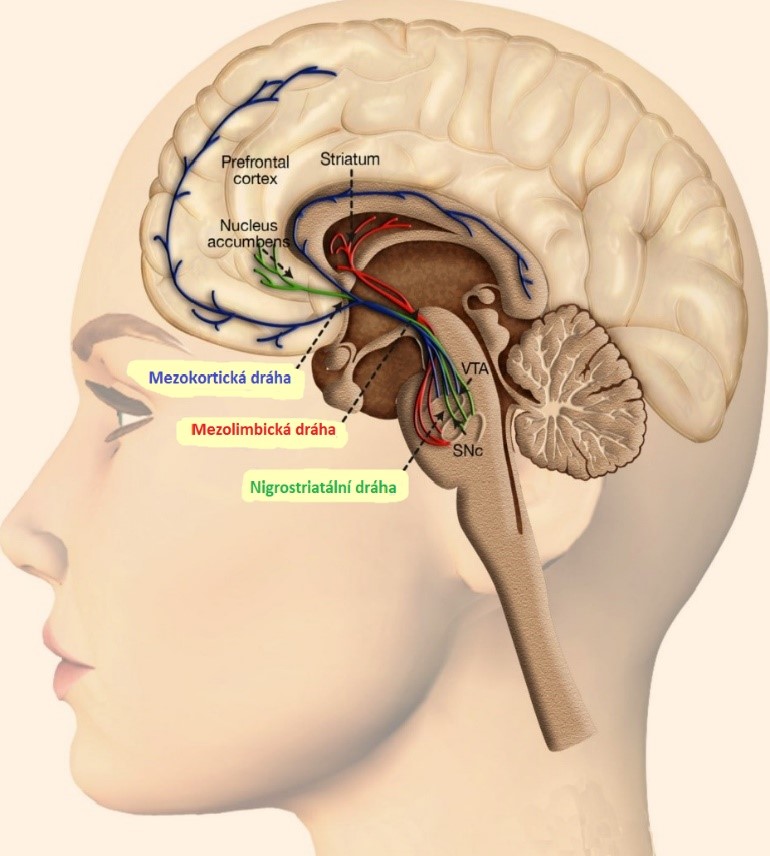
Akutní zvýšení hladiny dopaminu po užití amfetaminu má za následek dočasné zlepšení analytických dovedností a krátkodobé paměti, navýšení koncentrace a pozornosti a zvýšení motivace vykonávat monotónní činnost. Zcela logicky se tyto pozitivní účinky projevují především při užití nižších dávek (10 až 40 mg orálně u lidí bez tolerance). Na druhou stranu, extrémně vysoká dopaminergní aktivita (tzv. hyperdopaminergní stav), která nastává po užití excesivních dávek amfetaminu (60 mg + orálně u lidí bez tolerance), může vést k paranoie a v krajním případě až ke vzniku akutní toxické psychózy (Shoptaw et al., 2009; Bramness et al., 2012; Ilieva et al., 2015; Spencer et al., 2015; Vasan & Olango, 2022).
Noradrenalin
Noradrenalin (l-1-3,4 – Dihydroxyphenyl -2-aminoethanol) je dalším velice důležitým neurotransmiterem mozku, který se v první řadě podílí na regulaci bdělosti a stresové odezvy organismu. Právě díky této roli, je jeho aktivita v mozku nejnižší během spánku, přičemž během bdělého stavu postupně stoupá a vrcholí v situacích kdy je organismus vystaven vysokému stresu nebo nebezpečí. Přesně v těchto chvílích zajišťuje výtok noradrenalinu přípravu organismu k boji nebo útěku (Hussain et al., 2022; NCBI, 2022).

Kromě této primární role, se noradrenalin rovněž podílí na regulaci kognitivních procesů jako je tvorba vzpomínek a schopnost si konkrétní vzpomínky vybavit. Dále se pak, podobně jako dopamin, zapojuje do regulace pozornosti a koncentrace a v neposlední řadě také reguluje míru intenzity určitých emocí, mezi které patří i úzkost (Tully & Bolshakov, 2010; Bahtiyar et al., 2020; Hussain et al., 2022).

Podobně jako dopamin, je noradrenalin syntetizován v mozku, konkrétně v části, jež nese název Locus coeruleus. Jak je patrné z obrázku, tak celý noradrenergní systém zasahuje do veškerých oblastí mozku, od sekce zadní, kde je umístěn mozeček (Cerebellum, centrum motoriky), přes oblast střední, kde se nachází Amygdalu (regulace emocí a stresové odezvy), až po oblast přední, kde je lokalizována přední kůra mozková (Prefrontální cortex, osobnost, vyšší exekutivní dovednosti jako logické uvažování) (Downs & McElligott, 2010; Hussain et al., 2022).
V rámci CNS má noradrenalin primárně excitační účinky. Tudíž, jeho zvýšená aktivita probouzí mozek do aktivního stavu. Nicméně, při napojení na noradrenergní receptor subtypu Alfa-2, působí noradrenalin inhibičně, čímž snižuje neurální aktivitu (Hussain et al., 2022).
Mimo mozek, plní noradrenalin roli hlavního neurotransmiteru sympatické nervové soustavy (která je součástí autonomní periferní nervové soustavy) v oblastech míchy, břicha a Merkelových buněk umístěných v kůži (Hamill et al., 2012; Alshak & Das, 2022; Hussain et al., 2022). V případě stresové odezvy organismu je noradrenalin vypouštěn, společně s chemicky příbuzným adrenalinem, z nadledvinek do krevního řečiště, kde plní roli stresového hormonu, podobně jako adrenalin. V roli hlavního neurotransmiteru sympatické nervové soustavy a stresového hormonu zajišťuje fyziologickou přípravu organismu na boj nebo útěk, která zahrnuje zvýšení srdeční frekvence a krevního tlaku, roztažení zorniček, uvolňování glukózy z energetických zásob, zvyšování průtoku krve do kosterního svalstva, snižování průtoku krve do trávicího systému a blokaci vyprazdňování (Hamill et al., 2012; Alshak & Das, 2022; Hussain et al., 2022).
Obrázek níže znázorňuje distribuci autonomní periferní nervové soustavy v těle, která se dělí na zmíněnou sympatickou nervovou soustavu a dále pak na parasympatickou, která je často označována anglickým termínem ‘rest and digest system’. Jak tedy tento anglický termín napovídá, tak parasympatická nervová soustava zajišťuje činnost organismu v klidovém režimu, a tudíž její zvýšená aktivita stimuluje proces trávení, zúžení průdušek, zmenšení zorniček, a zpomalení srdeční činnosti (Alshak & Das, 2022).

Noradrenalin, který se nachází v periferní sympatické nervové soustavě, je podobně jako dopamin, syntetizován z fenylalaninu a tyrosinu v nadledvinkách, stejnými enzymy jako periferně se vyskytující dopamin. Naproti tomu, noradrenalin, který se vyskytuje v CNS je syntetizován enzymem dopamin β-monooxygenázou ze samotného dopaminu (Musacchiom, 2013; Hussain et al., 2022).
Sympaticko-centrální stimulační drogy jako amfetamin nebo kokain zvyšují aktivitu noradrenalinu jak v CNS, tak i v periferní sympatické nervové soustavě, což následně vede k produkci psychofyziologických stimulačních účinků jako je zvýšený pocit bdělosti, mentální stimulace, svalový třes, nechutenství, zúžení cév, zvýšení srdeční činnosti, zvýšení krevního tlaku, rozšíření zorniček a trnutí čelistí. Při chronickém užívání a následném akutním vysazení amfetaminu, se pak noradrenalin podílí na produkci celé řady negativních psychických symptomů abstinenčního syndromu, a to včetně bažení po droze (craving), pocitu psychické podrážděnosti, úzkosti, a zvýšené stresové reaktivitě (Downs & McElligott, 2010; Ferrucci et al., 2019).
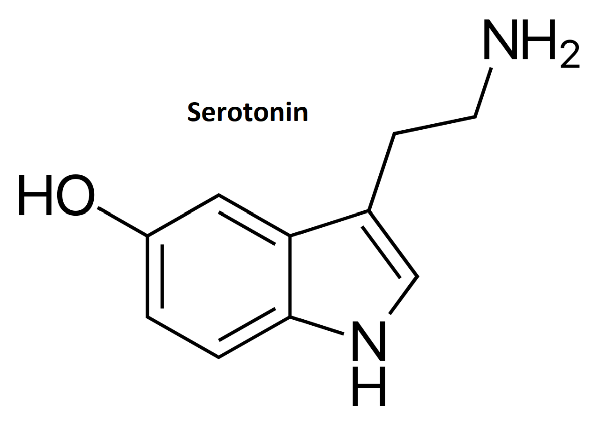
Serotonin
Serotonin (5-Hydroxytryptamin) je třetí monoaminový neurotransmiter (monoaminy = dopamin, noradrenalin, serotonin a také histamin) na jehož aktivitu má užití amfetamin značný vliv. V rámci CNS, plní serotonin hned několik rolí, z čehož ty nejdůležitější zahrnují modulaci kognitivních procesů a nálady. Serotonin se pak dále zapojuje i do regulace pocitů odměny, učení, paměti, spánkového cyklu a příjmu potravy (Fischer & Ullsperger, 2017; Bakshi & Tadi, 2021; Bamalan et al., 2022).
V CNS je serotonin produkován v Raphe nucleusu a jak je patrné na obrázku, tak celá serotoninergní dráha protíná veškeré sekce mozku. Vzhledem k tomu, že serotonin patří mezi monoaminové neurotransmitery, tak asi moc nepřekvapí, že jeho aktivita má značný vliv na aktivitu ostatních monoaminových drah mozku. Tomuto napomáhá i skutečnost, že serotoninergní dráha okupuje, v mnoha případech, stejné oblasti mozku jako ta dopaminergní a noradrenergní (Bakshi & Tadi, 2021; Bamalan et al., 2022)

Serotonin, který se nachází v mozku má primárně inhibiční roly. Tedy, jeho zvýšená aktivita způsobuje potlačení neurální aktivity. Serotonin, je však občasně, také kategorizován jako neuromodulátor, jelikož jeho nižší centrální aktivita zvyšuje aktivitu dopaminergní, což může následně vést až k impulzivnímu chování. Serotoninergní aktivita má také významný vliv na aktivitu drah kyseliny glutamové (zkráceně – glutamát – hlavní excitační neurotransmiter CNS) a kyseliny-gama-amino-máselné (zkráceně – GABA – hlavní inhibiční neurotransmiter CNS) (Ciranna, 2006; Miyazaki et al., 2012; Bakshi & Tadi, 2021; Bamalan et al., 2022; Desrochers et al., 2022).
Dlouhou dobu se rovněž usuzovalo, že patologické změny v serotoninergním systému, včetně snížené hladiny serotoninu, stojí za vznikem klinické deprese. Nicméně, novější poznatky naznačují, že neurobiologický původ deprese nemá s abnormalitami serotoninergního systému nic společného, a to i přesto, že klinicky užívaná antidepresiva, které mají relativně vysokou efektivitu léčby této duševní poruchy, prakticky zvyšují hladinu serotoninu v CNS (Bamalan et al., 2022; Chu & Wadhwa, 2022; Moncrieff et al., 2022).
Možná poněkud překvapivě, se až 90 % serotoninu nachází mimo CNS v enterochromafinních buňkách trávicí soustavy, kde reguluje střevní pohyby. Dalších 8 % serotoninu se pak nachází v krevním řečišti, kde se váže na krevní destičky, které ho využívají k zúžení (vazokonstrikci) nebo rozšíření (vazodilataci) cév a nakonec pouhé 1 % až 2 % serotoninu se nachází v CNS, kde plní roli neurotransmiteru (Vanhoutte, 1987; Berger et al., 2009; Bakshi & Tadi, 2021).
Serotonin je tělem syntetizován z esenciální aminokyseliny zvané tryptofan pomocí enzymů tryptofan hydroxylázy a aromatické L-aminokyseliny dekarboxylázy. Jelikož se jedná o aminokyselinu esenciální, tak si ji tělo není schopno syntetizovat samo a je jí nutné získávat ze stravy (Bamalan et al., 2022). Potraviny bohaté na tryptofan zahrnují vejce, kuřecí maso, mléko, banán a mnoho dalších. Podobně jako dopamin, není orálně podaný serotonin schopný penetrovat mozkovou bariéru. (Young, 2007). Proto jsou zde vhodnější suplementy obsahující tryptofan či jeho metabolit 5-hydroxytryptofan, které na rozdíl od serotoninu, dokáží mozkovou bariéru penetrovat, a tudíž mohou být využity serotoninergními neurony v Raphe nucleusu k syntéze samotného serotoninu (Young, 2007; Richard et al., 2009; Friedman, 2018; Maffei, 2020).

Byť není serotoninergní dráha primárním cílem amfetaminu v CNS, tak při dostatečně vysoké koncentraci je amfetamin schopen způsobit jak vypuštění serotoninu z neuronů, tak i blokaci jeho zpětného vychytávání (Kuczenski & Segal, 1997; Eiden & Weihe, 2011; Miller, 2011). Přesné behaviorální důsledky tohoto mechanismu nejsou prozatím zcela známy. Nicméně, existující výzkumy naznačují, že zvýšená serotoninergní aktivita, která nastává při užití vysokých dávek amfetaminu vede k posílení euforických účinků a modulaci návykového potenciálu této látky (současná výplava dopaminu a serotoninu – zvyšuje návykový potenciál dané látky, platí i pro amfetamin; výplava samotného serotoninu – snižuje návykový potenciál dané látky) (Kuczenski & Segal, 1997; Fischer & Ullsperger, 2017).
Endorfiny
Endorfiny (α-Endorfin, β-Endorfin, γ-Endorfin) jsou látky spadající do kategorie peptidových hormonů a neuropeptidů, které se v rámci centrální a periferní nervové soustavy podílí na regulaci příjmu potravy a trávicího traktu, bolesti, emocí, stresové odezvy a pocitů odměny (Sprouse-Blum et al., 2010; Chaudhry & Grossman, 2021).
Endorfiny, jsou stejně jako ostatní opioidní peptidy, tvořeny spletitou sekvencí několika aminokyselin. Díky tomu je jejich molekulární struktura, ve srovnání se standardními neurotransmitery, podstatně komplexnější (Li et al., 2012; Chaudhry & Grossman, 2021). Obrázek níže vyobrazuje molekulární strukturu v pořadí α (Alfa), β (Beta) a γ (Gama) endorfinů.



V CNS jsou endorfiny produkovány v hypofýze, což je hlavní endokrinní žláza lidského těla, která produkuje četné množství hormonů. Samotná hypofýza se nachází hned pod hypothalamem (Chaudhry & Grossman, 2021).

Ze tří zmíněných endorfinů je nejvíce prozkoumán beta-endorfin, který v CNS plní jak roli inhibiční, tak i tu neuromodulační. Jeho zvýšená aktivita tedy vede, buď to, k potlačení neurální aktivity či modulaci aktivity ostatních přilehlých drah mozku. Beta-endorfin vykonává tyto svoje role prostřednictvím endogenní opioidní dráhy mozku, která zasahuje jak do limbického systému, tak i mozkového kmene a míchy (Nummenmaa & Tuominen, 2018; Chaudhry & Grossman, 2021). Jak je patrné z obrázku, tak části opioidního systému v limbických sférách zasahují i do oblastí mezokortikolimbické dopaminergní dráhy. Díky této skutečnosti mají endorfiny značný vliv na funkci dopaminergní dráhy, jelikož jejich zvýšená aktivita vede k vypuštění dopaminu v mezokortikolimbickém systému (Merrer et al., 2009; Nummenmaa & Tuominen, 2018; Chaudhry & Grossman, 2021). Opioidní dráha využívá ke své správné funkci i další opioidní neuropeptidy, mezi které patří i leu a met-enkefaliny a dynorfiny. Zatímco enkefaliny produkují podobné účinky jako endorfiny, a tím tedy zvyšují hladinu dopaminu, tak dynorfiny naopak blokují účinky endorfinů a enkefalinů, čímž hladinu dopaminu zase snižují (Bruijnzeel, 2009; Merrer et al., 2009; Knoll & Carlezon, 2010; Mongi-Bragato et al., 2018; Cullen & Cascella, 2022).

Vzhledem k tomu, že opioidní dráha sahá až do periferní nervové soustavy, tak jsou endorfiny schopny aktivovat opioidní receptory i v těchto oblastech nervové soustavy. Zde plní roli analgetika, tedy látky, která svojí aktivitou potlačuje fyzickou bolest. Tuto roli však endorfiny plní i v rámci CNS (Chaudhry & Grossman, 2021).
Nás však bude více zajímat role endorfinů ve spojitosti s regulací pocitů odměny po užití návykových látek jako je amfetamin.
V tomto ohledu se zdá, že návykové stimulační látky, včetně amfetaminu či kokainu způsobují zvýšené uvolňování endorfinů a met-enkefalinů, což vede k produkcí hédonických stavů jako je pocit intenzivní slasti a euforie (Berridge, 2009; Guterstam et al., 2013; Berridge & Robinson, 2016; Mongi-Bragato et al., 2018). Tyto hédonické pocity jsou stěžejním komponentem pocitu odměny, který se dostavuje, jak při konzumaci přirozených hédonických podnětů jako je snězení jídla, tak i těch méně přirozených jako je konzumace drog. Tedy jinak řečeno, bez existence hédonických stavů bychom nebyli schopni pocit odměny nikterak vnímat (Berridge, 2009; Berridge & Robinson, 2016).
V anglické psychologické literatuře je produkce hédonického stavu nazývána jako ‘liking reaction’, tedy líbivá či sympatická, potažmo hédonicky příjemná reakce / odezva. Endorfiny tyto stavy produkují neurochemickou aktivací tzv. hédonického systému mozku (angl. liking system), který je tvořen velice malými oblastmi mozku, které nesou název hédonické hotspoty (Berridge, 2009; Berridge & Robinson, 2016).
Jeden z nejvýznamnějších hédonických hotspotů mozku se nachází v mezokortikolimbické dopaminergní dráze, konkrétně v jádře Nucleus accumbens. Nicméně, jak je patrné z obrázku níže, tak mozek disponuje i dalšími hédonickými hotspoty, které se nacházejí v přední kůře mozkové, Ventrálním pallidu (část Bazální ganglie – střední oblast mozku) a mozkovém kmeni. Zajímavostí je skutečnost, že samotný dopamin nedokáže tyto hotspoty aktivovat, přičemž, endorfiny ano. Další neurotransmitery, jež jsou schopny tyto hotspoty aktivovat zahrnují endokanabinoidy (anadamid a 2-arachidonoylglycerol) a GABA (Berridge, 2009; Berridge et al., 2009; Faure et al., 2010; Castro & Berridge, 2014; Berridge & Robinson, 2016).

Sympatická reakce (liking reaction), tedy produkce hédonických stavů je jeden ze dvou základních komponentů pocitu odměny. Druhým komponentem je pak, anglicky řečeno, ‘wanting reaction’, tedy chtíč a motivace vyhledávat podněty produkující sympatickou reakci. Jak je patrné na, dříve zmíněném schématu mozku, tak tento chtíč (wanting) je zprostředkován dopaminergní dráhou mozku, přesněji řečeno její zvýšenou aktivitou, která je způsobena uvolněním dopaminu (Berridge, 2009; Berridge & Robinson, 2016).
Takže tedy ve zkratce; zatímco sympatickou reakci reguluje opioidní systém, v čele s endorfiny, tak chtíč po sympatické reakci zase reguluje systém dopaminergní (Berridge & Robinson, 2016).
Pokud jde o samotný amfetamin, tak nálezy zvířecích studií konzistentně potvrzují, že jeho administrace zvyšuje hladinu endorfinů a met-enkefalinů v opioidní dráze mozku, což má za následek aktivaci hédonických hotspotů a následnou produkci hédonické sympatické odezvy (Olive et al., 2001; Berridge & Kringelbach, 2015). Uvolnění neuropeptidů navíc podporuje i zvýšené uvolňování dopaminu v dopaminergní dráze, což zase vede k tvorbě asociativního učení mezi užitím amfetaminu a následnou hédonickou odezvou, v podobě sympatické reakce jako je pocit euforie (liking reaction). Zvýšená aktivita dopaminu zde navíc přiřazuje vysokou hodnotu k odměně (pocit slasti a euforie), kterou amfetamin vyvolává a taktéž podporuje tvorbu dlouhodobé motivace vyhledávat a konzumovat amfetamin (Berridge, 2009; Guterstam et al., 2013; Berridge & Robinson, 2016; Volkow et al., 2016; Mongi-Bragato et al., 2018; Morales & Berridge, 2020).
Naprosto totožný mechanismus pak reguluje pocit odměny, po užití amfetaminu, i u lidí (Berridge & Robinson, 2016). Nicméně, zde je nutné doplnit, že výsledky lidských studií nejsou zcela konzistentní s daty ze studií provedených na zvířatech. Důvodem jsou zde protichůdné nálezy studií, kde některé poukázali na zvýšenou aktivitu endorfinů a met-enkefalinů po užití amfetaminu, zatímco jiné nikoli (Colasanti, et al., 2012; Guterstam et al., 2013; Mongi-Bragato et al., 2018). I přes tyto značně kontradikční nálezy, se dá do značné míry usuzovat, že amfetamin skutečně dokáže tyto hotspoty u lidí aktivovat, a to jednak kvůli produkci pocitu intenzivní slasti (dle kvalitativního výzkumu, se jedná o jeden z hlavních pozitivních důvodů, proč lidé po prvním užití, pokračují s užíváním amfetaminu/ů), a dále pak také kvůli nálezům jiných studií, které potvrdili zvýšenou aktivitu GABA systému při užití této drogy, přičemž právě GABA je jedním z dalších neurotransmiterů, jež je schopný tyto body aktivovat (Faure et al., 2010; Tritsch et al., 2012; Berridge & Kringelbach, 2015; Addison, et al., 2020).
Mechanismus účinků II
Terminologie
Ještě předtím, než se pustíme do popisu mezi-synaptického a nitrobuněčného mechanismu působení amfetaminu, tak je nutné si definovat několik odborných termínů, kterým se v této sekci bohužel nevyhneme. Pokud definice následujících termínů již znáte, tak se klidně můžete přesunout k samotnému popisu mechanismu účinků. Nicméně těm z Vás, kteří tyto termíny nikdy neslyšeli, doporučuji důkladně nastudovat tuto kapitolu.
Mezi-Synaptická štěrbina (angl. Synaptic cleft)
Prostor mezi neurony, do kterého jsou vypouštěny neurotransmitery (Caire et al., 2022).
Pre-synaptický neuron (angl. Presynaptic neuron)
Neuron, který se nachází před mezi-synaptickou štěrbinou. Neurotransmitery jsou z tohoto neuronu vypouštěny do mezi-synaptické štěrbiny (Caire et al., 2022).
Post-synaptický neuron (angl. Postsynaptic neuron).
Neuron, který se nachází za mezi-synaptickou štěrbinou. Neurotransmitery se po průchodu mezi synaptickou štěrbinou pojí na receptory tohoto neuronu (post-synaptální receptory) (Caire et al., 2022). Obrázek níže znázorňuje pre-synaptický neuron, mezi-synaptickou štěrbinu a post-synaptický neuron.

Monoaminový transportér
Biologická membrána tvořena proteiny na povrchu pre-synaptického neuronu, která zajišťuje zpětné vychytávání monoaminových neurotransmiterů (dopamin, noradrenalin a serotonin) s mezi-synaptické štěrbiny zpět do pre-synaptického neuronu (Caire et al., 2022). Obrázek níže vyobrazuje 2 D a 3 D podobu dopaminergního transportéru.

DAT (angl. Dopamine transporter) – Dopaminergní transportér.
NET (angl. Norepinephrine transporter) – Noradrenergní transportér.
SERT (angl. Serotonin transporter) – Serotoninergní transportér.
Výše znázorněné akronymy jsou zkratkami názvů tří druhů monoaminových transportérů, s kterými se setkáte v odborné vědecké literatuře (převážně v anglické).
Katecholamin
Chemická látka, která se skládá z benzenového kruhu a dvou hydroxylových skupin na kterou je napojen postranní aminový řetězec. Typickým zástupcem katecholaminu v lidském těle je zmíněný dopamin, a dále pak také noradrenalin a adrenalin (Fitzgerald, 2011; Paravati et al., 2021). Horní obrázek znázorňuje pyrokatechol a dolní pak dopamin.


Pasivní difuze
Proces, při kterém molekula (např. amfetamin) pronikne přes biologickou membránu (např. povrch pre-synaptického neuronu) z oblasti s vyšší koncentrací (mezi-synaptická štěrbina) do oblasti s koncentrací nižší (vnitřní oblast pre-synaptického neuronu). Jedná se o nejdůležitější mechanismus, který umožňuje drogám projít biologickou membránou. Látky rozpustné v tucích jsou schopny projít biologickou membránou snadněji, jelikož samotné membrány jsou tvořeny lipidy (tuky) (Cooper, 2000; Stillwell, 2016). Obrázek níže znázorňuje proces pasivní difuze.

Cytosol
Nitrobuněčná tekutina, která omývá vnitřní struktury neuronu (NCBI – cytosol, 2022).
Vezikula
Nitrobuněčný váček obklopený lipidovou membránou obsahující neurotransmitery (Chanaday et al., 2019). Obrázek po pravé straně zobrazuje vnitřní obsah pre-synaptického neuronu, včetně vezikul (angl. synaptic vesicles). Samotné vezikuly se pak nachází v cytosolu neuronu.

Stopový amin
Stopové aminy (např. fenylethylamin) jsou endogenní (v těle přirozeně se vyskytující) látky, které v CNS plní neuromodulační roli. Tyto látky jsou strukturálně podobné samotným monoaminům, avšak na rozdíl od nich jsou v CNS k nalezení pouze ve stopovém množství. Stopové aminy vznikají jako vedlejší produkt metabolizačního procesu monoaminů. Alternativně je tělo získává ze stravy, zpracováním esenciálních a neesenciálních aminokyselin. Existují však důkazy, které naznačují, že pro jejich tvorbu v CNS existuje speciální neuromodulační systém, který k jejich syntéze monoaminů nevyužívá (Burchett & Hicks, 2006). V roli neuromodulátora, tyto látky ovlivňují hladinu monoaminů v mezi-synaptické štěrbině, a to konkrétně tím, že jejich hladinu zvyšují. Tohoto docilují pomocí schopnosti blokovat monoaminové transportéry, vázat se na VMAT2 nitrobuněčný transportér a aktivovat TAAR1 nitrobuněčný receptor (definice VMAT2 a TAAR1 je k nalezení níže). Tedy, disponují stejnými farmakologickými účinky jako samotný amfetamin, avšak na rozdíl od něj, jsou tělem metabolizovány velice rapidně. Proto se délka trvání jejich farmakologických účinků pohybuje v řádu několika málo minut (Grandy, 2007; Pei et al., 2016; Gainetdinov et al., 2018). Obrázek níže znázorňuje molekulární strukturu, již zmíněného, stopového aminu fenylethylaminu a monoaminového neurotransmiteru dopaminu.


Receptor stopových aminů 1 (angl. Trace amine-associated receptor 1) – TAAR1
Jedná se o jeden z šesti známých nitrobuněčných aminových receptorů. Majoritní většina těchto receptorů se nachází mimo CNS v bílých krvinkách, žaludku, tenkém střevě a dvanáctníku. Zbytek těchto receptorů se pak nachází v pre-synaptických monoaminových neuronech, kde regulují četné nitrobuněčné procesy, včetně produkce cAMP (nitrobuněčný posel výměny informací), blokace a obrácení chodu monoaminových transportérů, a množství vypouštěných monoaminů s pre-synaptických neuronů do mezi-synaptické štěrbiny. Tento druh receptoru je aktivován stopovými aminy a také samotným amfetaminem (Schwartz et al., 2018; Liu et al., 2020; Dodd et al., 2021; NCBI – TAAR1, 2022). Obrázek níže znázorňuje 3 D strukturu tohoto receptoru, přičemž zelené struktury znázorňují stopové aminy, které se pojí na receptor.

Adenylátcykláza (AC)
Adenylátcykláza je enzym, který katalyzuje přeměnu adenosintrifosfátu na cyklický adenosinmonofosfát (cAMP). Tento enzym je lokalizován v buněčné membráně a stává se aktivním při stimulaci G-protein receptorů jako je, výše zmínění receptor TAAR1 (Duman & Nestler, 1999; NCBI – ADCY1, 2022).

Cyklický adenosinmonofosfát (cAMP)
Zatímco neurotransmitery fungují jako primární posel CNS, přenášející chemickou informaci mezi neurony, tak cAMP plní roli sekundárního posla přenášejícího chemickou informaci uvnitř neuronu. Při aktivaci nitrobuněčného TAAR1 receptoru (např. amfetaminem) dochází ke zvýšené produkci této látky. Zvýšená produkce této látky poté vede k aktivaci enzymu proteinkináza A (Duman & Nestler, 1999; Sassone-Corsi, 2012; Patra et al., 2021). Obrázek níže vyobrazuje proces konverze adenosintrifosfátu na cAMP, kterou zajišťuje enzym adenylátcykláza.

Fosforylace
Proces, při kterém dochází k napojení fosfátové skupiny (PO 3−4) na proteiny. Výsledkem tohoto procesu může být změna struktury proteinů v enzymech, což se projevuje změnou jejich funkce a činnosti (Nestler & Greengard, 1999; Ardito et al., 2017). Obrázek níže znázorňují serin (aminokyselinu) před a po fosforylaci. Přidaná fosfátová skupina je na dolním obrázku reprezentována červeno-oranžovým řetězcem.

Proteinkináza A (PKA)
Jedná se o enzym, který se nachází v cytoplazmě neuronů. Tento enzym se stává aktivní ve chvíli, kdy se na něj napojí cAMP. Poté tento enzym zajistí fosforylaci cílového proteinu, v tomto případě monoaminového transportéru. Dalo by se skoro říct, že tento enzym plní roli třetího posla výměny informací, jelikož přenáší chemickou informaci, kterou s sebou nese cAMP až do cílového proteinu. Hlavním důvodem, proč cAMP není schopen přenést informaci o změně funkce monoaminového transportéru je skutečnost, že samotný cAMP zpravidla neúčinkuje v cílové buňce proteinu. Fosforylace monoaminového transportéru zapříčiněná aktivitou enzymu PKA vede k blokaci tohoto transportéru. Výsledkem této akce je poté neschopnost transportéru zpětně vychytávat monoaminy s mezi-synaptické štěrbiny zpět do pre-synaptického neuronu (Robertson et al., 2009 Sitte & Freissmuth, 2009; Ramamoorthy et al., 2011; Miller, 2011; Bermingham & Blakely, 2016; Foster & Vaughan, 2017). Znázorněný obrázek reprezentuje počítačem generovanou 3 D podobu PKA.

Proteinkináza C (PKC)
Jedná se o další druh cytoplazmatického enzymu. Podobně jako je tomu u proteinkinázy A, je tento enzym uveden do chodu aktivací receptoru TAAR1 stopovými aminy či amfetaminem. Alternativně může tento enzym aktivovat zvýšená koncentrace nitrobuněčného diglyceridu a vápníku, jehož hladinu je právě amfetamin schopný značně zvýšit. Aktivace tohoto enzymu také způsobuje fosforylaci monoaminových transportérů. Nicméně, v tomto případě dochází, kromě blokace, také k obratu jejich chodu. Tedy, na místo zpětného vychytávání začne transportér monoaminy naopak vypouštět zpět do mezi-synaptické štěrbiny (Robertson et al., 2009 Sitte & Freissmuth, 2009; Ramamoorthy et al., 2011; Miller, 2011; Vaughan, & Foster, 2013; Underhill et al., 2014; Bermingham & Blakely, 2016; Foster & Vaughan, 2017). Znázorněný obrázek níže vykresluje výchozí strukturu a proces aktivace PKC nitrobuněčným vápníkem a diglyceridem.

Proteinkináza typu II podjednotka alfa závislá na vápníku/kalmodulinu (angl. Calcium/calmodulin-dependent protein kinase type II subunit alpha) – CAMK II Alfa
Jedná se o enzym, který spadá do kategorie cytoplazmatických enzymů proteinkinázy regulovaných ionizovaným vápníkem (Ca2+) a nitrobuněčným proteinovým poslem kalmodulinem. Primární funkcí tohoto enzymu je udržování homeostáze Ca2+ v CNS, tak aby nedošlo k abnormalitám elektrického přenosu informací mezi jednotlivými neurony. Aktivace tohoto enzymu však může také měnit funkci dopaminergního monoaminového transportéru (zkráceně DAT) prostřednictvím procesu fosforylace. Amfetamin aktivuje tento enzym zvýšením nitrobuněčné koncentrace ionizovaného vápníku, což má za následek fosforylaci DAT, díky které dochází k masivnímu úniku dopaminu s pre-synaptických dopaminergních neuronů do mezi-synaptické štěrbiny (Fog et al., 2006; Robertson et al., 2009; Ramamoorthy et al., 2011; Vaughan, & Foster, 2013; Bermingham & Blakely, 2016; Underhill et al., 2014; Ardito et al., 2017; Foster & Vaughan, 2017). Obrázek níže znázorňuje 3 D strukturu CAMKII Alfa.

Vezikulární monoaminový transportér 2 (VMAT2)
VMAT2 je nitrobuněčný membránový protein, který zajišťuje přesun zpětně odchycených monoaminů z cytosolu do vezikul. Další rolí tohoto transportéru je pak přemístění monoaminů z vezikul zpět do cytosolu. Díky tomu, že má amfetamin podobnou molekulární strukturu jako samotné monoaminy, tak je schopný se na VMAT2 napojit a využít ho pro vstup do samotných vezikul (Sulzer et al., 2005; Eiden, & Weihe, 2011; Martin & Le, 2021).
pH gradient
Tento termín odkazuje na změnu hladiny pH uvnitř vezikuly. Za běžných okolností je vnitřní prostředí vezikul kyselejší nežli cytoplazma uvnitř neuronu. U lidí, má neurální cytosol zásaditou hodnotu pH v rozmezí 7 až 7.4 stupňů. Na druhou stranu pH uvnitř vezikul dosahuje kyselé hodnoty 5.5 stupňů. Při napojení VMAT2 transportéru na vezikulu, dojde ke změně vezikulární hladiny pH s 5.5 na 7.25 stupňů (kyselé prostředí se stává zásaditým), což vede k zahájení transportu monoaminů přes VMAT2 do cytosolu neuronu. Po vniknutí do vezikul způsobuje amfetamin změnu hladiny pH (tzv. kolaps pH gradientu). Konkrétně zde účinkuje zásaditě a snižuje hladinu kyselosti (nad pH 7), což vede k úniku monoaminů, přes VMAT2, do cytosolu (Sulzer et al., 1993; Blackmore et al., 2001; Ahdut-Hacohen et al., 2004; Ruffin et al., 2014; Freyberg et al., 2016; Sulzer et al., 2016; Chen et al., 2020).
Monoamin oxidáza
Jedná se o skupinu enzymů, které v těle obstarávají metabolizaci monoaminů a stopových aminů. Lidské tělo disponuje dvěma druhy těchto enzymů; Monoamin oxidázou A (MAO A) a Monoamin oxidázou B (MAO B). Zatímco MAO A preferenčně metabolizuje serotonin a noradrenalin, tak MAO B zase zajišťuje metabolizaci stopových aminů. U dopaminu se dlouhou dobu usuzovalo, že se na jeho metabolizaci podílí současná aktivita obou dvou enzymů. Novější výzkum, však naznačuje, že za degradací dopaminu stojí převážně aktivita enzymu MAO A. Ve velmi vysokých koncentracích, je amfetamin schopný inhibovat (blokovat) aktivitu těchto enzymů, což zabraňuje metabolizaci cytoplazmatických monoaminů. Toto následně vede ke kumulaci monoaminových neurotransmiterů v cytosolu pre-synaptických neuronů (Reyes-Parada et al., 2020; Cho et al., 2021). Obrázky níže znázorňují 3 D strukturu MAO A a MAO B.


Post-synaptický serotoninergní receptor 5HT1A
Post-synaptický serotoninergní receptor, který je aktivován samotným serotoninem. Aktivace tohoto receptoru může mít na svědomí snížení agresivity a impulzivity nebo také navýšení sociální družnosti (převážně nálezy zvířecích studií). U lidí, se jedná o jediný post-synaptický receptor, na který se amfetamin pojí a způsobuje jeho aktivaci (odborně tzv. agonizaci). Pojivost (odborně tzv. afinita) amfetaminu na tento receptor je relativně nízká (Winstanley et al., 2005; de Boer & Koolhaas, 2005; Thompson et al., 2007; Cervantes & Delville, 2009; NCBI – 5HT1A, 2022; TED – Amphetamine, 2022). Obrázek po pravé straně znázorňuje 3D podobu receptoru 5HT1A.

Mechanismus účinků III
Nitrobuněčný a mezi-synaptický mechanismus účinků
Ve chvíli, kdy amfetamin penetruje mozkovou bariéru, tak se začne selektivně vázat na pre-synaptické transportéry (DAT, NET, a SERT) monoaminového systému mozku, který zahrnuje dopaminergní, noradrenergní a serotoninergní soustavy. Zde je vhodné doplnit, že v nižších koncentracích, je amfetamin více selektivní vůči katecholaminovému systému mozku, který zahrnuje dopaminergní a noradrenergní soustavy. Nicméně, při dostatečně vysokých koncentracích (užití vysoké dávky), je schopný ovlivnit i funkci systému serotoninergního (Martin & Le, 2022; Shoar et al., 2022; Vasan & Olango, 2022).
Znázorněné schéma vyobrazuje mezi-synaptický a nitrobuněčný mechanismus účinků amfetaminu v rámci dopaminergního systému. Vzhledem k tomu, že je mechanismus účinků této látky pro všechny tři monoaminové dráhy mozku shodný, tak nám postačí, když se zde zaměříme pouze na systém dopaminergní (Miller, 2011; Martin & Le, 2022).

Takže tedy, po vstupu do dopaminergního systému, se začne amfetamin vázat na DAT, kde působí jako kompetitivní inhibitor (toto platí i pro NET a SERT). Jinak řečeno, nám zde amfetamin bojuje o svou pozici na DAT se samotným dopaminem, přičemž zde platí pravidlo, že čím vyšší je jeho koncentrace v CNS, tak tím vyšší je pravděpodobnost, že tento souboj s dopaminem nakonec vyhraje a připojí se na samotný DAT. Po napojení na DAT, amfetamin tento transportér dočasně zablokuje a zároveň jím i pronikne do nitrobuněčného cytosolu pre-synaptického dopaminergního neuronu. Za zmínku zde stojí skutečnost, že část amfetaminu, jež se nachází v mezi-synaptické štěrbině, se dostává do vnitřního prostoru pre-synaptického neuronu pomocí, dříve zmíněného, procesu pasivní difuze (Eiden & Weihe, 2011; Ledonne et al., 2011; Miller, 2011; Sitte & Freissmuth, 2015; Hasenhuetl et al., 2019; Martin & Le, 2022; Shoar et al., 2022; Vasan & Olango, 2022).
Po samotném průniku do pre-synaptického neuronu, se amfetamin začne vázat na VMAT2 transportér, a to ze značně vysokou afinitou (jinak řečeno preferenční pojivostí). Důvodem, proč je amfetamin schopný se na VMAT2 napojit, je skutečnost, že má velice podobnou molekulární strukturu jako samotný dopamin či stopové aminy (jako je, ku příkladu, fenylethylamin). Ve chvíli, kdy se amfetamin připojí na vezikulární VMAT2 transportér, tak dojde k jeho dočasné blokaci, a dále se pak tímto transportérem, také dostává až do samotných vezikul, kde způsobí kolaps Ph gradientu. Následkem této akce je poté masivní únik dopaminu (noradrenalinu a serotoninu) z vezikul, přes VMAT2, zpět do neurálního cytosolu (Eiden & Weihe, 2011; Ledonne et al., 2011; Miller, 2011; Sitte & Freissmuth, 2015; Hasenhuetl et al., 2019; Martin & Le, 2022; Shoar et al., 2022; Vasan & Olango, 2022).
Kromě této akce, je amfetamin rovněž schopný se navázat na TAAR1 nitrobuněčný receptor, na který působí jako velice silný agonista. Jinak řečeno, zde amfetamin působí jako silný aktivátor tohoto receptoru, podobně jako samotné stopové aminy. Následkem aktivace tohoto receptoru je zvýšená produkce enzymu AC, který poté katalyzuje přeměnu adenosintrifosfátu na cyklický adenosinmonofosfát (cAMP), který plní roli sekundárního nitrobuněčného posla. Tento posel poté vyšle aktivační signál enzymu PKA, který následně provede fosforylaci DAT (připojení fosfátové skupiny na DAT, NET a SERT), která zapříčiní internalizaci DAT. Při samotném procesu internalizace dochází k nekompetitivní blokaci tohoto transportéru, která je způsobená stažením DAT do pre-synaptického neuronu. V tuto chvíli, tedy není DAT schopný vykonávat svojí funkci, a tudíž přestane vychytávat dopamin s mezi-synaptické štěrbiny (Eiden & Weihe, 2011; Ledonne et al., 2011; Miller, 2011; Sitte & Freissmuth, 2015; Hasenhuetl et al., 2019; Martin & Le, 2022; Shoar et al., 2022; Vasan & Olango, 2022).
Tímto však nitrobuněčný mechanismus účinků amfetaminu nekončí, jelikož aktivace TAAR1 uvede do chodu i enzym PKC, k jehož aktivaci přispívá i skutečnost, že amfetamin zvyšuje nitrobuněční hladinu vápníku, na jehož zvýšenou koncentraci je právě tento enzym velice citlivý. Výsledkem aktivace enzymu PKC je znovu fosforylace DAT (a také NET a SERT), avšak v tomto případě, může kromě internalizace, dojít i k obrácení chodu DAT, který začne vypouštět nahromaděný cytosolický dopamin zpět do mezi-synaptické štěrbiny (Eiden & Weihe, 2011; Ledonne et al., 2011; Miller, 2011; Sitte & Freissmuth, 2015; Hasenhuetl et al., 2019; Martin & Le, 2022; Shoar et al., 2022; Vasan & Olango, 2022).
Obrácení chodu DAT, však není závislé pouze na PKC fosforylaci, jelikož k této akci může dojít i při fosforylaci DAT enzymem CAMKII alfa, který je podobně jako enzym PKC, velice citlivý na nitrobuněční hladinu vápníku, kterou amfetamin značně zvyšuje. Pokud tedy dojde k aktivaci CAMKII alfa, tak se rapidně zvyšuje šance, že dojde k obrácení chodu DAT a masivnímu úniku dopaminu (a také noradrenalinu a případně i serotoninu) do mezi-synaptické štěrbiny (Eiden & Weihe, 2011; Ledonne et al., 2011; Miller, 2011; Steinkellner et al., 2012; Sitte & Freissmuth, 2015; Hasenhuetl et al., 2019; Martin & Le, 2022; Shoar et al., 2022; Vasan & Olango, 2022).
Posledním důsledkem aktivace receptoru TAAR1, je snížení rychlosti přenosu elektrických vzruchů mezi jednotlivými dopaminergními neurony. Tato akce zabraňuje hyperdopaminergnímu stavu, který je charakterizován nadměrnou a nekontrolovanou elektrickou neurotransmisí mezi jednotlivými dopaminergními neurony. Zde je však nutné doplnit, že vysoká koncentrace amfetaminu v CNS (užití vysoké dávky), naopak může hyperdopaminergní stav vyvolat. V tomto případě však nikoli v důsledku nadměrné a nekontrolované elektrické transmise, ale kvůli masivnímu úniku dopaminu, která vede k nadměrné stimulaci post-synaptických dopaminergních receptorů. Výsledkem této aktivity je poté možná manifestace symptomů akutní toxické psychózy (Ledonne et al., 2011; Miller, 2011; Revel et al., 2011; Daberkow et al., 2013; Marinelli, & McCutcheon, 2014; McCutcheon et al., 2020; Danielsson et al., 2021; Novak & Seeman, 2022).
Amfetamin, taktéž působí, jako reverzibilní kompetitivní inhibitor enzymů MAO A a MAO B, které se podílejí na degradaci monoaminů. Jak napovídá popis této akce, tak amfetamin zde znovu bojuje o svou pozici na těchto enzymech s monoaminy a pokud je jeho koncentrace v CNS dostatečně vysoká, tak se na tyto enzymy napojí a způsobí dočasnou blokaci jejich funkce, která je ukončena jeho metabolickou eliminací a vyloučením. Blokace těchto enzymů zabraňuje degradaci cytosolických monoaminů, což dále přispívá k zvýšenému úniku dopaminu (a dalších monoaminů), přes obráceně fungující monoaminové transportéry, zpět do mezi-synaptické štěrbiny (Reyes-Parada et al., 2020).
Výsledkem všech těchto nitrobuněčných účinků, jež amfetamin zapříčiňuje, dochází k dramatickému zvýšení hladiny monoaminů v mezi-synaptické štěrbině, které se následně pojí na receptory post-synaptických neuronů. Výsledkem této akce, je poté extrémní zvýšení aktivity monoaminového systému mozku, která má za následek celou řadu psychofyziologických účinků, které jsou blíže popsány v sekci psychických a fyzických účinků. V rámci mezi-synaptického působení, se amfetamin také váže na post-synaptické serotoninergní receptory typu 5HT1A (jediný post-synaptický receptor na který se amfetamin pojí), avšak pouze s nízkou afinitou. Přesný důsledek této aktivity není znám (Martin & Le, 2021; TED – Amphetamine, 2022). Níže znázorněné schéma zobrazuje mezi-synaptický mechanismus účinků amfetaminu v rámci dopaminergního systému.

Novější psychofarmakologické poznatky také naznačili, že zvýšená aktivita monoaminového systému, má na svědomí vypuštění endogenních neuropeptidů, včetně met-enkefalinu a beta-endorfinů, které přispívají k produkci dříve zmíněných hédonických stavů, prostřednictvím aktivace hédonických hotspotů mozku (Berridge, 2009; Le Merrer et al., 2009; Nishi et al., 2011; Colasanti et al., 2012; Guterstam et al., 2013; Castro & Berridge, 2014; Berridge & Robinson, 2016; Mongi-Bragato et al., 2018; Bhatia et al., 2022).
V případě met-enkefalinu se zdá, že amfetamin způsobuje navýšení jeho aktivity, přes nadměrnou dopaminergní stimulaci post-synaptických receptorů, což vede k iniciaci nitrobuněčné signalizační kaskády (aktivace sekundárního nitrobuněčného posla cAMP), vedoucí k uvolnění acetylcholinu v přilehlé cholinergní dráze mozku. Vyplavený acetylcholin poté stimuluje muskarinové receptory (jeden ze dvou typů receptorů cholinergní dráhy; druhý typ je pak nikotinový acetylcholinový receptor), které vyšlou další signalizační kaskádu, přes sekundárního nitrobuněčného posla cAMP do sousedních neuronů opioidní dráhy, s kterých se následně uvolní met-enkefalin. Vypuštěný met-enkefalinu poté aktivuje hédonické hotspoty mozku (Berridge, 2009; Le Merrer et al., 2009; Nishi et al., 2011; Castro & Berridge, 2014; Berridge & Robinson, 2016; Mongi-Bragato et al., 2018; Zhao et al., 2019; Bhatia et al., 2022; Kudlak & Tadi, 2022).
S ohledem na zvýšenou aktivitu beta-endorfinů, výzkum naznačuje, že podobně jako v případě met-enkefalinu, zde hraje roli excesivní dopaminergní aktivita. Následkem této akce je znovu spuštění nitrobuněčné signalizační kaskády, která vede k uvolnění beta-endorfinů v přilehlé opioidní dráze. Výsledkem této aktivity je poté znovu aktivace hédonických hotspotů mozku (Berridge, 2009; Le Merrer et al., 2009; Nishi et al., 2011; Guterstam et al., 2013; Castro & Berridge, 2014; Berridge & Robinson, 2016; Bhatia et al., 2022).
Mechanismus účinků IV
Sekundární mechanismus účinků
Ačkoli je amfetamin ve svém mechanismu působení, relativně selektivní vůči monoaminovému systému, tak i přesto, je schopný ovlivnit aktivitu přilehlých drah mozku, které jsou s monoaminovým systémem propojeny. Mezi tyto systémy patří jak glutamatergní a histaminergní dráha, tak i hlavní inhibiční dráha GABA. (Acevedo et al., 2008; Li et al., 2010; Sotomayor-Zárate et al., 2010; Eiden & Weihe, 2011; Nishi et al., 2011; Underhill et al., 2014; Jiao et al., 2015; Li et al., 2017; Bhatia et al., 2022).
Pokud jde o samotné mechanismy, kterými amfetamin ovlivňuje aktivitu přilehlých drah, tak v případě dráhy glutamatergní, dochází k akutnímu vypuštění glutamátu (500% navýšení hladiny glutamátu po užití dávky 4 mg/kg u hlodavců) v důsledku zvýšené aktivity dopaminergního systému. Konkrétní mikrocelulární mechanismus, v tomto případě, zahrnuje spuštění nitrobuněčné signalizační dráhy uvnitř dopaminergních neuronů, přes kterou se následně vyšle signál do přilehlých glutamatergních neuronů, s kterých se poté uvolní glutamát. Dle nálezů zvířecích studií, přispívá zvýšená aktivita této dráhy k produkci lokomotivních účinků amfetaminu, mezi které patří stereotypní pohyby těla. Dalším důsledkem zvýšené glutamatergní aktivity, může být vznik excitační neurotoxicity, při které dochází k nadměrné stimulaci NMDA a AMPA glutamatergních receptorů (dva hlavní receptory glutamatergní dráhy) samotným glutamátem. Toto poté vede k nadměrnému přítoku mezi-synaptického vápníku, který zapříčiní úmrtí neuronů. Masivní úmrtí glutamatergních neuronů se může projevit epileptickými záchvaty nebo kognitivními deficity (které mají podobné symptomy jako Alzheimerova choroba – porucha paměti, snížení intelektu) (Li et al., 2010; Nishi et al., 2011; Underhill et al., 2014; Barker-Haliski, & White, 2015; Li et al., 2017; Wang, & Reddy, 2017; Bhatia et al., 2022; Vasan & Olango, 2022).
Histaminergní dráha je dalším systémem mozku, která je farmakologickým působením amfetaminu značně zasažena. Důvodem je skutečnost, že samotný histamin, patří do skupiny monoaminových neurotransmiterů, a proto tedy pre-synaptické neurony této dráhy disponují VMAT2 transportéry, na které se amfetamin pojí s vysokou afinitou. Podobně jako je tomu u VMAT2 v dopaminergních neuronech, způsobuje vstup amfetaminu do tohoto transportéru kolaps vezikulárního Ph gradientu, který vede k úniku histaminu do cytosolu. Zdali je však amfetamin schopný obrátit chod histaminergních transportérů a způsobit tak vyplavení tohoto neurotransmiteru do mezi-synaptické štěrbiny, zůstává záhadou. Existují však důkazy, které naznačují, že příbuzný metamfetamin, je skutečně schopný histamin vypustit. Přesto však není mechanismus této aktivity důkladně zmapován. Pokud však amfetaminy skutečně dokáží navýšit aktivitu histaminergní dráhy, tak by to mohlo mít značný vliv na zesílení lokomotivní aktivity vyvolané těmito látkami, a to kvůli skutečnosti, že má histamin v rámci CNS ryze excitační účinky (Munzar et al., 2004; Acevedo et al., 2008; Eiden & Weihe, 2011; Bhatia et al., 2022; Patel et al., 2022).
Poslední neurální dráhou na jejíž aktivitu má amfetamin vliv, je dráha kyseliny gama-aminomáselné (GABA). Studie provedené na hlodavcích, zde poskytli omezené důkazy, které poukázali na zvýšenou aktivitu této dráhy po podání amfetaminu, jež měla za následek snížení dopaminergní aktivity v určitých oblastech mozku. K této aktivitě dochází po užití vysokých dávek v hodnotě 2 mg/kg. Přesné behaviorální dopady této akce nejsou pro zatím u lidí známy (Berridge et al., 2009; Faure et al., 2010; Sotomayor-Zárate et al., 2010; Nishi et al., 2011; Jiao et al., 2015; Bhatia et al., 2022).
Podle nálezů jiných studií, pak může dlouhodobé užívání amfetaminů (od amfetaminu, přes extázi až po pervitin) způsobit abnormality neurotransmise v dráze GABA, které se projevují sníženou aktivitou tohoto systému. Na základě těchto poznatků, se dá usoudit, že se tyto abnormality mohou podílet na vzniku amfetaminové toxické psychózy v důsledku nadměrné aktivity excitačních drah mozku (dopaminergní, noradrenergní a glutamatergní), kterou není narušený inhibiční GABA systém schopný správně korigovat (Berridge et al., 2009; Faure et al., 2010; Sotomayor-Zárate et al., 2010; Nishi et al., 2011; Ahn et al., 2015; Jiao et al., 2015; Bhatia et al., 2022).
Farmakokinetika
Pokud jde o samotnou vstřebatelnost amfetaminu, tak v případě orálního podání dosahuje hodnoty 75 % a je závislá na pH trávicího traktu. Orálně užitá dávka se v průměru vstřebá do krevního řečiště v rozmezí 4 až 6 hodin od užití. Zajímavostí je pak skutečnost, že obsah žaludku nemá na míru vstřebatelnosti žádný vliv, nicméně jídla bohatá na tuky mohou zpomalit absorpci, čímž dojde k pomalejšímu nástupu účinků (míra vstřebatelnosti však zůstává stejná) (de la Torre et al., 2004; FDA, 2013; NLM, 2017; Drug bank (a), 2022).
Ve chvíli, kdy se amfetamin dostane z gastrointestinální soustavy do krevního řečiště, tak se začne vázat na plazmatické bílkoviny, přičemž reportovaná vázanost je kolem 20 %. V případě orálního užití dochází k vrcholové plazmatické koncentraci po 3 až 7 hodinách po podání dávky (de la Torre et al., 2004; FDA, 2013; NLM, 2017; Drug bank (a), 2022).
Po vstupu do oběhové soustavy dochází k distribuci amfetaminu do valné většiny tkání těla, s tím že nejvyšší koncentrace jsou k nalezení v mozkomíšním moku a samotné tkáni mozku. Vrcholová psychotropní odezva orálně užité dávky se dostavuje v rozpětí 1 až 3 hodin, zatímco v případě nitrožilního užití dochází k maximální odezvě během 15 minut od podání (de la Torre et al., 2004; FDA, 2013; NLM, 2017; Drug bank (a), 2022).
Amfetamin je tělem zpracován jak hepaticky (jaterně), tak i centrálně a periferně (enzymy centrální a periferní sympatické nervové soustavy), přičemž následné vylučování zbytkového množství amfetaminu a metabolitů probíhá renálně, tzn. pomocí ledvin (de la Torre et al., 2004; FDA, 2013; Glennon, 2013; NLM, 2017; Drug bank (a), 2022).
Biologický poločas rozpadu, který odkazuje na dobu, potřebnou k tomu, aby daná látka ztratila 50 % svojí farmakologické aktivity v důsledku metabolizace a eliminace, je u amfetaminu variabilní a závislý na konkrétním enantiomeru a hladině pH moči. Pokud má moč standardní hladinu pH (4.6 pH až 8 pH), tak se biologický poločas rozpadu pohybuje v rozmezí 9 až 11 hodin u pravotočivého enantiomeru d-amfetaminu a 11 až 14 hodin u levotočivého l-amfetaminu. Vysoce kyselá moč zkracuje biologické poločasy obou dvou enantiomerů na 7 hodin a na druhou stranu vysoce alkalická moč prodlužuje tyto poločasy až na přibližně 34 hodin (de la Torre et al., 2004; FDA, 2013; NLM, 2017; Drug bank (a), 2022).
V případě, že pH moči dosahuje standardních hodnot, tak je 30 až 40 % amfetaminu vyloučeno v nezměněné podobě. Zbytek je pak metabolizován různými enzymy na metabolity, které jsou poté rovněž vyloučeny močí. Stopové množství amfetaminu je vylučováno i potem (Barnes et al., 2008). Pokud pH moči dosahuje vysoce zásaditých hodnot tak je z těla vyloučeno menší množství amfetaminu v nezměněné podobě a naopak, pokud je moč nadměrně kyselá, tak stoupá množství vyloučeného amfetaminu v nezměněné podobě. Po orálním užití je amfetamin v moči k nalezení do tří hodin od podání a přibližně 90 % užité dávky je vyloučeno do tří dnů od užití (de la Torre et al., 2004; FDA, 2013; NLM, 2017; Drug bank (a), 2022).
Metabolizace I
Metabolický proces amfetaminu
Amfetamin je primárně metabolizován enzymem CYP2D6, který je součástí jaterního komplexu enzymů nesoucí název cytochrom P450, jehož grafická reprezentace je znázorněna níže (Wang et al., 2009; McDonnell & Dang, 2013; Gilani & Cassagnol, 2022).

Cytochrom P450 obstarává konverzi látek rozpustných v tucích (což je i amfetamin) na metabolity, které jsou snadněji rozpustné ve vodě, tak aby mohli být následně zpracovány ledvinami a vyloučeny močí. Kromě jater jsou enzymy cytochromu P450 v menší míře k nalezení i v krevní plazmě, různých tkáních těla, včetně střevních stěn a také různých orgánech včetně mozku, plic a ledvin (McDonnell & Dang, 2013).
Přestože enzym CYP2D6 tvoří pouze miniaturní frakci celého komplexu P450 (méně než 2 %), tak obstarává metabolizaci více jak 25 % všech klinicky užívaných léků (Wang et al., 2009). Tento enzym má navíc největší variabilitu exprese v rámci populace napříč všemi známými enzymy cytochromu P450. Například, asijská populace disponuje, ve srovnání s bělošskou populací, podstatně menším množstvím tohoto enzymu, což v konečném důsledku vede ke zpomalení metabolizace látek, které jsou tímto enzymem metabolizovány, což zase zvyšuje riziko předávkování. Nicméně, i v rámci bělošské populace existuje extrémní variabilita výskytu tohoto enzymu od případů, kdy ho někteří jedinci mají nadbytek až po případy, kdy ho někteří nemají vůbec (de la Torre et al., 2012; McDonnell & Dang, 2013; Teh & Bertilsson, 2013). Další věc, kterou je dobré o tomto enzymu vědět, je skutečnost, že některé látky jsou schopny plně blokovat jeho funkci, či přímo akutně redukovat jeho množství. Zcela logicky pak může dojít k negativní interakci mezi látkami, které jsou tímto enzymem metabolizovány (obzvlášť pokud jsou tyto látky užity současně) (Gilani & Cassagnol, 2022). Mezi látky, které blokují aktivitu enzymu CYP2D6 patří jak amfetamin/metamfetamin, tak i například některé alkaloidy obsažené v kratomu (de la Torre et al., 2012; Kamble et al., 2019). Naproti tomu látky, které selektivně redukují množství tohoto enzymu zahrnují substituované amfetaminy, včetně MDMA (extáze) a MDE (Eve – derivát extáze s podobnými účinky). V případě užití jediné dávky extáze, dochází po dvou hodinách od administrace k totální ztrátě tohoto enzymu po dobu 10 dnů (do té doby si tělo tento enzym znovu vytvoří) (de la Torre et al., 2012). Přesně kvůli této skutečnosti je kombinace amfetaminu/metamfetaminu s extází jednou z nejrizikovějších, jelikož u ní může dojít k radikálnímu zpomalení metabolizace a zvýšení toxicity obou látek, která může být fatální.

Pokud jde o samotný proces metabolizace amfetaminu enzymem CYP2D6, tak v prvním kroku dochází k aromatické a alifatické hydroxylaci, při které vznikají dva farmakologicky aktivní metabolity, para-hydroxyamfetamin a norefedrin. Tyto metabolity jsou posléze znovu zpracovány enzymem CYP2D6 na psychoaktivní para-hydroxy-norefedrin (Santagati et al., 2002; FDA, 2013; Glennon et al., 2013; Markowith & Patrick, 2017; Drug bank (a), 2022).
Metabolizace amfetaminu je také regulována dalšími enzymy včetně: Monooxygenázy obsahující flavin 3 (FMO3), Dopamin beta-hydroxylázy (DBH), Butyrátu — CoA ligázy (XM-ligáza) a Glycinu N-acyltransferázy (GLYAT) (Santagati et al., 2002; FDA, 2013; Glennon et al., 2013; Markowith & Patrick, 2017; Drug bank (a), 2022).
V rámci CNS je amfetamin metabolizován enzymem DBH na norefedrin a ten samí enzym se poté zapojuje (společně s enzymem CYP2D6) do metabolické konverze para-hydroxyamfetaminu na para-hydroxy-norefedrin (Santagati et al., 2002; FDA, 2013; Glennon et al., 2013; Markowith & Patrick, 2017; Drug bank (a), 2022).
Vedle enzymu CYP2D6, se na jaterní metabolické konverzi amfetaminu podílí i enzym FMO, který obstarává konverzi amfetaminu na farmakologicky aktivní para-hydroxyamfetamin a farmakologicky neaktivní fenylaceton, který je poté zpracován neznámým enzymem na para-hydroxy-fenylaceton a kyselinu benzoovou, která je následně konvertována enzymem GLYAT na kyselinu hippurovou (Santagati et al., 2002; FDA, 2013; Glennon et al., 2013; Markowith & Patrick, 2017; Drug bank (a), 2022).
Jak již bylo zmíněno, tak konverze amfetaminu na aktivní a neaktivní metabolity je přímo závislá na Ph moči. Pokud dosahuje Ph moči standardních hodnot, tak je tělem vyloučeno něco mezi 30 % až 40 % amfetaminu v nezměněné podobě, zatímco dalších 50 % je vyloučeno v podobě farmakologicky neaktivních metabolitů a zbylých 10 % až 20 % je pak vyloučeno ve formě aktivních metabolitů (Santagati et al., 2002; FDA, 2013; Glennon et al., 2013; Markowith & Patrick, 2017; Drug bank (a), 2022).
Metabolizace II
Přehled farmakologicky aktivních metabolitů
Amfetamin disponuje několika farmakologicky aktivními metabolity, které mohou do menší míry modulovat jeho psychofyziologické účinky (Drug bank (a), 2022). To, do jaké míry tyto metabolity ovlivní psychofyziologické účinky amfetaminu, zcela logicky závisí na množství, které vznikne při samotné metabolické konverzi. V této sekci se tedy, ve stručnosti, podíváme na mechanismus účinků těchto metabolitů.
Hydroxyamfetamin
Hydroxyamfetamin (nebo také 4-hydroxyamfetamin / para-hydroxyamfetamin) je z chemického hlediska substituovaný amfetamin, který se od samotného amfetaminu liší přidanou hydroxylovou (OH) skupinou na čtvrté pozici benzenového kruhu. Podobně jako amfetamin, je tato látka tvořena dvěma optickými enantiomery a sice l-hydroxyamfetaminem a d-hydroxyamfetaminem. D/l-hydroxyamfetamin je hlavní psychoaktivní metabolit amfetaminu (Nakagawasai et al., 2012; Feio-Azevedo et al., 2017; Liu & Li, 2018; Liu et al., 2020; Drug bank (b), 2022; NCBI (a), 2022).

Mechanismus účinků této látky je velice podobný mechanismu účinků amfetaminu. Tedy, jedná se o blokátor monoaminových transportérů, který je zároveň agonistou TAAR1 receptorů, způsobující uvolnění monoaminů. Nicméně, ve srovnání s amfetaminem má tato látka větší preferenci vůči TAAR1 receptorům umístěných v noradrenergních neuronech. Tudíž výsledným účinkem této látky je převážně centrální a sympatická stimulace, postrádající euforii. Výzkum provedený na hlodavcích, také naznačil, že tato látka blokuje aktivita MAO-A enzymu, což v konečném důsledku navyšuje hladinu všech tří monoaminů (Nakagawasai et al., 2012; Feio-Azevedo et al., 2017; Liu & Li, 2018; Liu et al., 2020; Drug bank (b), 2022; NCBI (a), 2022).
Po odeznění euforických účinků, vede kumulace tohoto metabolitu v lidském těle k prodloužení centrálně-periferních reziduálních stimulačních účinků amfetaminu (Nakagawasai et al., 2012).
V medicíně je tato látka užívána v podobě očních kapek, které po aplikaci způsobují rozšíření očních zorniček. Využití této látky v medicíně je omezeno pouze na diagnostické účely (Nakagawasai et al., 2012; Feio-Azevedo et al., 2017; Liu & Li, 2018; Liu et al., 2020; Drug bank (b), 2022; NCBI (a), 2022).
Para-hydroxy-norefedrin
Para-hydroxy-Norefedrin (nebo také 4-hydroxy-norefedrin) je chemický analog norefedrinu a substitut amfetaminu, který disponuje hydroxylovou skupinou (OH) na čtvrté pozici benzenového kruhu a beta pozici aminového řetězce. Jedná se o minoritní metabolit amfetaminu, který vzniká při metabolické konverzi primárního farmakologicky aktivního metabolitu hydroxyamfetaminu. Podobně jako je tomu u jiných sympatických aminů, je tento metabolit tvořen dvěma optickými enantiomery (d-enantiomer / l-enantiomer) (Santagi et al., 2002; Feio-Azevedo et al., 2017; NCBI (b), 2022; NCBI c, 2022).

Díky svojí struktuře není para-hydroxy-norefedrin schopný penetrovat mozkovou bariéru. Kvůli této skutečnosti, má tento metabolit převážně periferně-sympatické stimulační účinky, které se projevují zvýšením činnosti kardiovaskulární soustavy. Nicméně, stopové množství této látky vzniká i při degradaci amfetaminu v CNS v důsledku aktivity enzymu DBH. Výzkum zde naznačuje, že v rámci CNS má tento metabolit podobný mechanismus účinků jako samotný amfetamin. Avšak podobně jako hydroxyamfetamin má tento metabolit preferenční pojivost vůči TAAR1 receptorům umístěných v noradrenergních neuronech, výsledkem čehož je centrálně-periferní stimulace, postrádající euforii. (Santagi et al., 2002; Feio-Azevedo et al., 2017; NCBI (b), 2022; NCBI c, 2022).
Podobně jako u předchozího metabolitu, vede kumulace této látky v lidském těle k prodloužení reziduálních centrálně-periferních stimulačních účinků (Nakagawasai et al., 2012).
Na rozdíl od hydroxyamfetaminu, není tato látka v medicíně užívána (NCBI c, 2022).
Norefedrin
Norefedrin (nebo také fenylpropanolamin) je substituovaný amfetamin, který obsahuje hydroxylovou skupinu (OH) na beta pozici aminového řetězce. Jedná se o druhý minoritní metabolit amfetaminu, který vzniká při degradaci amfetaminu působením enzymu DBH. Na rozdíl od valné většiny jiných sympatických aminů má norefedrin až osm optických stereoizomerů, mezi které patří d/l norefedrin, d/l-efedrin, d/l pseudoefedrin a d/l-cathin (cathin je přirozeně se vyskytující alkaloid obsažený v květině Kata jedlá, který má podobné účinky jako efedrin z Chvojníku) (Young & Glennon, 2000; Rothman et al., 2003; Riviere & Papich, 2009; Gupta, 2012; Drug bank c, 2022; NCBI (d), 2022).

Podobně jako para-hydroxy-norefedrin má tento metabolit primárně periferní účinky. Nicméně stopové množství této látky rovněž vzniká v CNS při degradaci amfetaminu v důsledku aktivity enzymu DBH. Mechanismus účinků této látky je totožný s mechanismem účinků ostatních farmakologicky aktivních metabolitů amfetaminu. Jedná se tedy o látku, která selektivně blokuje NET transportéry a současně vyvolává uvolnění noradrenalinu v důsledku aktivace TAAR1 noradrenergních receptorů. Výsledné psychotropní účinky této látky zahrnují centrálně-sympatickou stimulaci, která postrádá výraznou euforii. Výzkum však také naznačil, že tato látka způsobuje v omezené míře blokaci DAT transportérů a uvolnění dopaminu. Oproti amfetaminu je však dopaminergní aktivita této látky přibližně 10krát nižší (Young & Glennon, 2000; Rothman et al., 2003; Riviere & Papich, 2009; Gupta, 2012; Drug bank c, 2022; NCBI (d), 2022).
Po odeznění euforických účinků amfetaminu, vede kumulace tohoto metabolitu v lidském těle k prodloužení reziduálních centrálně-periferních stimulačních účinků (Nakagawasai et al., 2012).
Historicky se tato látka užívala v medicíně jako dekongestant (lék na zduřelé nosní sliznice), vazokonstriktor (lék na stažení cév, podporující zástavu krvácení) a anorektikum (lék na obezitu, který potlačuje chuť k jídlu). Nicméně, kvůli relativně nízké efektivitě a vedlejším účinkům, které zahrnovaly extrémní zatížení kardiovaskulární soustavy (kardiotoxicita), byl norefedrin postupně z trhu stažen. V dnešní době se však stále užívá ve veterinární medicíně (Riviere & Papich, 2009; Gupta, 2012; Drug bank c, 2022; NCBI (d), 2022).
Bezpečné užívání I
Způsob užití
V této kapitole se společně podíváme na různé způsoby užití a dávkování amfetaminu.
Tabulka níže znázorňuje různé způsoby užití amfetaminu a jejich míru vstřebatelnosti. Berte však na vědomí, že znázorněné míry vstřebatelnosti jsou pouze orientační. Důvodem značného rozptylu úrovní vstřebatelnosti u jednotlivých způsobů užití jsou rozdílné nálezy studií, které jsou v tomto článku citovány (Inchem, 1998; Harris & Sequera, 2003; Hendrickson et al., 2008; Gupta et al., 2009; Lile et al., 2011; Chem Europe, 2022; Price & Patel, 2022). Za zmínku také stojí i to, že vstřebatelnost drog je velmi často měřená v rámci zvířecích studií, a proto výsledná data nemusí korespondovat s reportovanou vstřebatelností u lidí (Musther et al., 2014). Navíc i v rámci výzkumů provedených na lidech se vstřebatelnost konkrétní látky může, mezi jednotlivými účastníky výzkumu, lišit, a to kvůli individuálním rozdílům, mezi které patří i biologické pohlaví (Soldin et al., 2011).
Vstřebatelnost jednotlivých způsobů užití
Orálně – 20 % – 75 % +
Intranasálně – 75 %
Inhalace – 37.4 %
Rektálně – 95 % – 99 %
Vaginálně – 95 % – 99 %
IV – 100 %
Intramuskulárně – 95 % – 100 %
Poznámky
IV / intravenózně – nitrožilní podání
Orálně – prosté pozření, bukálně (aplikace látky pod jazyk).
Orální vstřebatelnost amfetaminu je ovlivněna gastrointestinální Ph. Pokud je Ph gastrointestinálního traktu zásadité, tak se přes epitel (tenké střevo) vstřebá větší množství užité dávky do krevního řečiště. Na druhou stranu, pokud je Ph trávicího traktu kyselé, tak se do krevního řečiště vstřebá menší množství užité dávky (de la Torre et al., 2004; FDA 2013).
Intranasálně – šňupání
Inhalace – skleněnka určená na kouření tabáku, nahřívání na alobalu
37.4 % platí pro vstřebatelnost inhalovaného metamfetaminu u lidí a jedná se pouze o průměrnou hodnotu (Harris & Sequera, 2003). Na vstřebatelnost amfetaminu u této metody užití se autorovi nepodařilo najít důvěryhodné zdroje. Nicméně, vzhledem k chemické podobnosti obou dvou látek se dá usuzovat, že vstřebatelnost inhalovaného amfetaminu, bude velice podobná vstřebatelnosti inhalovaného metamfetaminu, ne-li dokonce stejná.
Rektálně – tampon, nebo aplikace drogy na tkáň (rektální sliznice)
Vaginálně – tampon, nebo aplikace drogy na tkáň (vaginální sliznice)
Nitrožilně – injekce
Intramuskulárně – injekce do svalu/ů
95 % – 100 % vstřebatelnost platí pro injekční intramuskulární administraci metamfetaminu holubům (Hendrickson et al., 2008). Dá se však usuzovat, že úroveň vstřebatelnosti této metody užití, bude u lidí rovněž značně vysoká.
Rizika různých metod užití
Nyní se v rychlosti zaměříme na některá rizika, které jsou spojena s výše vyjmenovanými metodami užití.
Orálně – jedná se o suverénně nejbezpečnější metodu užití. Přesto však u ní hrozí poškození ústních sliznic (pokud uživatel užije amfetamin bukálně a má ho v ústech příliš dlouho), poškození zubní skloviny, a možné riziko nechtěného předávkování (v důsledku delšího nástupu účinku oproti ostatním metodám a následnému opakovanému dávkování).
Intranasálně – méně bezpečná metoda užití nežli ta orální. Hrozí zde, poškození nosních sliznic a přenos infekce (jeli šňupátko sdíleno mezi uživateli).
Rektálně a vaginálně – relativně dost nebezpečné metody užití u které může dojí k poškození rektálních a vaginálních sliznic a předávkování v důsledku vysoké míry vstřebatelnosti.
Inhalace – zde se znovu jedná o relativně nebezpečnou metodu užití, jelikož zde hrozí možné poškození plic a ústních sliznic (které mohou být popáleny, horkými výpary), nebo také poškození zubní skloviny.
Nitrožilně a intramuskulárně – tyto dvě metody užití jsou extrémně nebezpečné, protože zde hrozí zvýšené riziko nechtěného předávkování v důsledku vysoké míry vstřebatelnosti, poškození cév, infekce v oblasti vpichu, a přenos krevních onemocnění (AIDS, hepatitida typu C). Navíc u těchto metod užití hrozí i zvýšené riziko rychlejšího vzniku psychické závislosti, jelikož se tímto způsobem amfetamin dostává do CNS velmi rapidně a také ve vysoké koncentraci, a to jednak, kvůli vysoké míře vstřebatelnosti a dále pak také kvůli tomu, že takto efektivně obchází metabolismus prvního průchodu (místo z žaludku do jater a poté až teprve do CNS, putuje, v tomto případě, okamžitě krví do CNS). U návykových látek zpravidla platí, že čím rychleji se dostanou do CNS ve větší koncentraci, tak tím snadněji na nich vzniká závislost, obzvláště pokud jsou užívány, metodami užití, umožňujícími rychlý vstup do CNS, často.
Graf níže znázorňuje nejpreferovanější metody užití amfetaminu uživateli. Jak je patrné, tak nejpopulárnější metodou užití je šňupání a pozření následované inhalací, injekční aplikací a poté dalšími méně tradičními způsoby užití jako je rektální, vaginální a intramuskulární užití (Statista, 2022).

Dávkování
Znázorněné dávkování je ryze orientační a není založeno na objektivních datech (objektivní data se totiž vztahují na lékařské dávkování, které bývá tradičně nižší než to rekreační). Na místo toho je odvozeno od průměrné množiny reportovaného dávkování uživatelů ze stránek Psychonautwiki (2022) a Erowid (2022). Prezentované množiny, v tabulce níže, se pak vztahují na intranasální užití vysoce kvalitního amfetaminu sulfátu/hydrochloridu u lidí bez tolerance.
Minimální psychotropní dávka (MPD) | 2.5 mg – 5 mg |
Nízká dávka | 5 mg – 10 mg |
Běžná dávka | 10 mg – 40 mg |
Vysoká dávka | 40 mg – 50 mg |
Silná dávka | 50 mg – 60 mg |
Excesivní dávka | 60 mg + |
LD50 – smrtelná dávka pro 50 % populace | 20 mg – 25 mg / kg |
Množina reprezentující LD50 je založena na statistické predikci u lidí bez tolerance, a proto je tedy do značné míry nepřesná. Byli zaznamenány případy, kdy někteří uživatelé brali i něco mezi 1 g až 5 g amfetaminu denně, a přesto u nich nedošlo k předávkování s fatálními následky. V těchto případech se jednalo o těžce závislé uživatele s masivní tolerancí. Na druhou stranu však byly zaznamenány i fatální případy předávkování při pozření dávky 1.3 mg / kg, což odpovídá 104 mg pozřeného amfetaminu u osoby vážicí 80 kg (Inchem, 1998; Healthline, 2022).
Přibližné dávkování ostatních metod užití
[table id=1 /]
Časový průběh
Znázorněné časové průběhy platí pro rekreační užití pouličního amfetaminu sulfátu/HCl vysoké kvality. Lékařský amfetamin může disponovat podstatně delší dobou trvání účinků, především pokud se jedná o tabletky s postupným (SR) či prodlouženým (ER/XR) uvolňováním (Weisler, 2005; Brams et al., 2008; Shoar et al., 2022). Uvedené hodnoty navíc odkazují na průměrnou délku trvání účinků při užití průměrné rekreační dávky (cca 10 mg až 40 mg) u jednotlivých způsobů užití. V praxi se tedy délka účinků může rapidně lišit, a to na základě užitého množství, počtu užitých dávek během jednoho sezení (opakované dávkování, nebo také tzv. redosing) způsobu užití, Ph trávicího traktu a moči, kompozice drogy (nekvalitní syntéza – větší podíl l-amfetaminu – má delší dobu trvání účinků než d-amfetamin, nebo racemický mix), individuální neurochemie, a celkové individuální odezvy organismu (Psychonautwiki 2022).
[table id=2 /]
Účinky
V této sekci se podíváme na psychické a fyzické účinky amfetaminu, které se dostavují při užití průměrné rekreační dávky (cca 10 mg až 40 mg).
Psychické účinky
Psychické účinky amfetaminu jsou charakterizované silným pocitem mentální stimulace, který je doprovázen pocitem dobré nálady až euforie. Mezi další prominentní psychické účinky patří zvýšená schopnost koncentrace a motivace vykonávat monotónní činnost/i. Při užití běžných dávek, postrádá psychický stav vyvolaný amfetaminem silný pocit intoxikace (jako je tomu např. při užití alkoholu) a svým charakterem je bližší účinkům kofeinu ‘na steroidech’ (ten však nemá tendenci produkovat tak výraznou euforii jako amfetamin). Na druhou stranu při užití vysokých dávek se může dostavit pocit mentální hyperstimulace, který je často doprovázen zrychleným tokem myšlenek, úzkostí a paranoiou. (Psychonautwiki, 2022).
Pozitivní | Mentální stimulace, pocit dobré nálady, euforie, zlepšení analytických dovedností (nižší dávky), zlepšení koncentrace (nižší dávky), zlepšení pozornosti (nižší dávky), zlepšení krátkodobé paměti (nižší dávky), zvýšení motivace (nižší dávky), zlepšení organizace myšlenek (nižší dávky), větší požitek z hudby (nižší i vyšší dávky), sociální disinhibice (vyšší dávka) |
Neutrální | Zvýšený pocit bdělosti, potlačení emocí (nižší dávky), zvýšené libido, potlačení sugestivity, zrychlený tok myšlenek (vyšší dávky), časová komprese (subjektivně vnímané zrychlení času) |
Negativní | Kompulzivní dávkování, inflace ega, podrážděnost (vyšší dávky), úzkost (při nástupu účinků / vyšší dávky), nespavost (reziduální efekt), snížení motivace (po odeznění hlavních účinků), letargie (po odeznění hlavních účinků), kognitivní vyčerpání (po odeznění hlavních účinků), mánie (u predisponovaných jedinců a při užití vyšší dávky) |
Fyzické účinky
Fyzické účinky amfetaminu jsou typicky doprovázeny pocitem silné fyzické stimulace, která se projevuje signifikantním navýšením fyzické výdrže a sympatickými účinky, které mohou zahrnovat zvýšení krevního tlaku a tělesné teploty, pocení, rozšíření zorniček (mydriáza), trnutí čelistí (bruxismus) a svalový třes. Vyšší hranice standardní rekreační dávky (cca 40 mg +) má tendenci produkovat citelnou fyzickou euforii, která má charakter velice příjemného mravenčení, které je nejvíce prominentní především v oblastech hlavy. Občasně se však může tento pocit přenést i do zbytku těla. Celkový charakter fyzické stimulace produkovaný amfetaminem lze popsat jako vnucený. To znamená, že s postupným navyšováním dávky dochází k projevům nedobrovolných svalových pohybů a narušení jemné motoriky (Psychonautwiki, 2022).
Pozitivní | Fyzická stimulace (nižší i vyšší dávky), zlepšení fyzické výdrže (nižší i vyšší dávky), fyzická euforie (vyšší dávky) |
Neutrální | Tachykardie (zrychlený srdeční tep), palpitace (negativně vnímané bušení srdce), mydriáza, bronchodilatace (rozšíření průdušek), odkrvení žaludku, nechutenství, pocit sucha v ústech, pocení, časté močení, bruxismus (vyšší dávka), potlačení orgasmu |
Negativní | Hypertenze (vysoký krevní tlak; + 30 mg/hg systolický a + 40 mg/hg diastolický při užití 40 mg d-amfetaminu u lidí bez tolerance), srdeční arytmie (vyšší dávky), vazokonstrikce (zúžení cév), bolest hlavy (vyšší dávky), svalový třes (vyšší dávky), dehydratace (vyšší dávky a při nedostatečné hydrataci), zvýšení tělesné teploty (střední až vyšší dávky), neschopnost se vymočit, nevolnost (vyšší dávky), dočasná erektilní dysfunkce |
Vizuální účinky
Ačkoli se vizuální účinky, při užití standardní rekreační dávky samotného amfetaminu zpravidla nedostavují, tak při užití vysokých dávek či kombinaci s jinými látkami (hlavně marihuana, disociativa a psychedelika), může k jejich manifestaci dojít (Psychonaut a, 2022).
Vizuální drifting Dýchání a roztékání se okolního světa | Oproti psychedelikům je tento vizuální fenomén velice mírný a projevuje se zpravidla při užití vysokých dávek nebo při kombinaci s marihuanou, disociativy a psychedeliky |
Změna vizuálního jasu Okolní svět se jeví být jasnější | Tento efekt se může dostavit i při užití standardní rekreační dávky a zpravidla nebývá natolik prominentní jako u psychedelik. Za produkcí tohoto jevu stojí mydriáza oči |
Vizuální tracery Jedná se o stopy různé délky a průhlednosti, které jsou zanechávány za pohybujícími se předměty | K tomuto jevu dochází buď při kombinaci s psychedeliky nebo při užití vysokých dávek vedoucí k insomnii (nespavosti) a následné spánkové deprivaci |
Vizuální drifting
Změna vnímaného vizuálního jasu

Vizuální tracery

Bezpečné užívání II
Základní principy bezpečného užívání
Nyní se společně podívejme na základní principy bezpečného užívání amfetaminu.
V první řadě je vhodné se vyhnout užívání nadměrných dávek (60 mg + orálně u lidí bez tolerance), tak aby se předešlo vzniku závažných negativních vedlejších účinků (např. závažná hypertenze, nespavost nebo psychický dojezd po odeznění účinků). Také je vhodné se vyhnout průběžnému navyšování dávky (tzv. redosing), které zpravidla nevede k produkci silnější euforie, ale na místo toho citelně prodlouží stav intoxikace, ke kterému se navíc mohou přidat nepříjemné psychofyziologické účinky (Wright et al., 2011).
Zcela logicky byste se měli vyvarovat kombinování amfetaminu s jinými látkami, kvůli možným interakcím (Horwitz et al., 2014; Althobaiti & Sari, 2016). Na případné psychofyziologické vedlejší účinky interakcí se můžete podívat v následující subsekci této kapitoly.
Vzhledem k tomu, že pouliční amfetamin není nikterak regulován, tak se jeho čistota a potence může dramaticky lišit v závislosti na zdroji s kterého ho dotyčný získal. Dle dat Evropského monitorovacího centra drogové problematiky z roku 2019 se průměrná čistota evropského amfetaminu pohybuje v rozmezí 13 % až 67 %. Právě kvůli těmto rozdílům v čistotě a možnému obsahu různých příměsí je vhodné pouliční amfetamin testovat reakční kapalinou, která dle zbarvení poukáže na přítomnost konkrétní látky ve vzorku. Tabulka níže popisuje zbarvení amfetaminu u pěti druhů reakčních kapalin.
Název reakční kapaliny | Zbarvení vzorku amfetaminu |
Marquis | Oranžová až hnědá |
Liebermann | Oranžová až červená |
Simon´s | Světle modrá až modrá (výchozí barva testu, barva se nemění) |
Mandelin | Zelená až tmavě zelená |
Froehde | Žádná barva nebo červená |
U reakčních kapalin mějte na paměti, že vám neodkryjí čistotu dané látky, ale pouze poukáží na její přítomnost ve vzorku. K účelům testování čistoty slouží jiné druhy kreačních kapalin (tzv. purity tests, česky testy čistoty), které jsou rovněž legálně dostupné, nicméně i ty nejsou schopny podat naprosto přesné informace o čistotě vzorku. Jednoduše zde platí pravidlo, že nejpřesnější informace o čistotě získáte laboratorní analýzou, která však není v rámci českých harm-reduction programů dostupná. Aby toho nebylo málo, tak některé reakční kapaliny nejsou schopny rozlišit substituty či deriváty určitých látek. Například Marquisova reakční kapalina, která se nachází i v populárním EZ testu, není schopná rozlišit vzorek amfetaminu od metamfetaminu (to samé zde platí i pro MDMA a MDA) a v obou případech se vzorek zbarví do oranžové až hnědé barvy. Proto je zde vhodné otestovat vzorek hned několika různými druhy reakčních kapalin (které je možné koupit na této stránce: https://www.protestkit.eu/) (Fregonese et al., 2021).
Pokud jde o samotnou administraci amfetaminu, tak jednoznačně nejbezpečnější je orální aplikace. Zde však mějte na paměti, že nástup účinků může klidně atakovat hranici 90 až 120 minut (hlavně pokud před užitím sníte tučné jídlo, které zpomaluje absorpci užité dávky a tím i nástup účinků). Druhou nejbezpečnější metodou užití je intranasální aplikace. Zde však ale může dojít k podráždění nebo dokonce i k poškození nosních sliznic (platí pro chronické užívání). U této metody administrace navíc hrozí riziko vzniku infekce, a to v případě užití nevhodných šňupátek typu bankovka nebo jejich společného sdílení mezi jednotlivými uživateli. Proto je lepší se této metodě užití vyhnout ve prospěch orální administrace a pokud se už pro tuto metodu užití dotyčný rozhodne, tak je třeba užít sterilních šňupátek (HRI, 2019; HRTSW – amphetamine, 2022; Rigoni et al., 2022).
Zbylé metody užití, včetně inhalace, nitrožilní, intramuskulární, rektální a vaginální aplikace, jsou značně rizikové, jelikož u nich hrozí větší riziko předávkování a pravděpodobnosti vzniku psychické závislosti (při častém a dlouhodobém užívání). Proto je lepší se těmto metodám užití zcela vyhnout (HRI, 2019; HRTSW – amphetamine, 2022; Rigoni et al., 2022).
V průběhu samotného stavu intoxikace je důležité dodržovat adekvátní pitný režim (0.25-0,6 l/h) a to v závislosti na míře fyzické aktivity. Vzhledem k tomu, že amfetamin značně potlačuje chuť k jídlu, tak je vhodné se před jeho užitím pořádně najíst, protože následujících 6 až 8 hodin to bude téměř nemožné. Pokud se dotyčný rozhodne jíst v samotném stavu intoxikace, tak je zde vhodnější dát přednost smoothie nebo jogurtovému drinku, jelikož pevná strava může vyvolat pocit nevolnosti v důsledku značného odkrvení žaludku, jež snižuje jeho schopnost efektivně zpracovávat snězené jídlo. Při zvýšené fyzické aktivitě je důležité, aby si dotyčný dal čas od času pauzu, tak aby předešel vyčerpání nebo přehřátí organismu (hypertermie) (HRI, 2019; HRTSW – amphetamine, 2022; Rigoni et al., 2022).
V neposlední řadě je důležité zmínit lékařské diagnózy u kterých může užití amfetaminu způsobit značné komplikace.
Psychické diagnózy
Porucha užívání návykových látek, klinická deprese, bipolární porucha, úzkostlivá porucha, anorexie, bulimie, mánie, psychóza, a schizofrenie (Heal et al., 2011; Martin & Le, 2022; Shoar et al., 2022).
Fyziologické diagnózy
Vysoký krevní tlak, srdeční problémy (např. arytmie, šelest), ateroskleróza, problémy s játry a ledvinami, Raynaudova nemoc, glaukom, a problémy se štítnou žlázou (Heal et al., 2011; Martin & Le, 2022; Shoar et al., 2022).
Ostatní
Alergie na sympatika a stimulanty, epilepsie, Touretteův syndrom, těhotné, a kojící ženy (Heal et al., 2011; Martin & Le, 2022; Shoar et al., 2022).
Interakce s dalšími látkami
Nyní se podíváme na potenciální psychofyziologické účinky způsobené interakcí mezi amfetaminem a dalšími psychotropními látkami. V rámci bezpečného užívání, pochopitelně platí, že by člověk neměl amfetamin kombinovat z jinými látkami. Nicméně, jak je znázorněno níže, tak ne všechny kombinace jsou vyloženě extrémně rizikové. I přesto však může u bezpečnějších kombinací dojít k manifestaci negativních symptomů, které mohou být značně nepříjemné. Také je dobré mít na paměti, že intenzita negativních symptomů se zpravidla zvyšuje proporcionálně s dávkou užité látkové kombinace (Cascorbi, 2012; Palleria et al., 2013; Coleman, & Pontefract, 2016; Althobaiti, & Sari, 2016; Niu et al., 2019). Závěrem je ještě třeba doplnit, že tato sekce zahrnuje pouze výčet těch nejprominentnějších vedlejších účinků vzájemných interakcí a nikoli jejich kompletní výčet.
Popis tabulky interakcí a definice akronymů, slangových označení a odborných termínů
(+) = zesílení účinků
(-) = snížení účinků
(+/-) = posílení nebo snížení účinků v závislosti na tom, které látky bylo užito více, např. pokud užijete vysokou dávku amfetaminu a nižší dávku alkoholu, tak účinky amfetaminu přebijí účinky alkoholu (potlačení opilosti a silný pocit mentální stimulace) a naopak pokud užijete více alkoholu než amfetaminu, tak alkohol přebije účinky amfetaminu (potlačení stimulačních účinků amfetaminu a pocit opilosti).
(+) Zátěž kardiovaskulární soustavy = zrychlená tepová frekvence (tachykardie), zúžení cév (vazokonstrikce), zvýšení krevního tlaku (hypertenze), palpitace (vnímaný tlukot srdce), arytmie (porucha rytmu srdce, nepravidelný tep), zvýšení srdeční spotřeby kyslíku.
(-) Zátěž kardiovaskulární soustavy = snížená tepová frekvence (bradykardie), roztažení cév (vazodilatace), snížení krevního tlaku (hypotenze), snížení srdeční spotřeby kyslíku.
(+) Návykový potenciál = tento termín odkazuje na zvýšení pravděpodobnosti vzniku psychické závislosti při dlouhodobém užívání návykové/vých látky/ek. Návykový potenciál se stupňuje, pokud obě současně užité látky současně zvyšují hladinu dopaminu v mezokortikolimbické dopaminergní dráze odměn (Crummy et al., 2020).
Fyzická stimulace = tento pojem odkazuje na zvýšenou aktivitu periferní sympatické nervové soustavy, která je způsobená zvýšenou aktivitou adrenalinu a noradrenalinu v periferní nervové soustavě.
MAOI = Monoamine Oxidase Inhibitors – blokátory monoamin oxidázy jsou látky (převážně antidepresiva), které blokují aktivitu enzymů monoamin oxidázy, které metabolizují monoaminy (dopamin, noradrenalin a serotonin). Díky této farmakologické akci zvyšují MAOI hladinu monoaminů v CNS (Laban & Saadabadi, 2022).
SSRI = Selective Serotonin Reuptake Inhibitors – selektivní blokátory zpětného vychytávání serotoninu jsou antidepresiva, které selektivně blokují SERT transportéry, čímž zvyšují hladinu serotoninu v mezi-synaptické štěrbině (Chu & Wadhwa, 2022).
SNRI = Serotonin and Noradrenaline Reuptake Inhibitors – selektivní blokátory zpětného vychytávání serotoninu a noradrenalinu jsou antidepresiva, které selektivně blokují SERT a NET transportéry, čímž zvyšují hladinu těchto dvou monoaminů v mezi-synaptické štěrbině (Sansone & Sansone, 2014).
NRI = Noradrenaline Reuptake Inhibitors – selektivní blokátory zpětného vychytávání noradrenalinu jsou látky (většinou antidepresiva), které selektivně blokují NET transportéry, čímž zvyšují mezi-synaptickou hladinu noradrenalinu v CNS (Sansone & Sansone, 2014).
Hypertermie = fyziologické či nefyziologické zvýšení tělesné teploty, lidově řečeno teplota (fyziologické zvýšení teploty – regulováno tělem, konkrétně hypothalamem / nefyziologické – způsobené užitím drogy, není regulováno hypothalamem) (Wasserman et al., 2021).
Ataxie = neurologický symptom projevující se poruchou pohybové koordinace (Hafiz, & De Jesus, 2022)
Serotoninový syndrom = život ohrožující stav, který je vyvolán excesivní hladinou serotoninu v CNS. Mezi symptomy tohoto stavu patří podrážděnost, halucinace, hypertermie, zúžení cév, pocit na zvracení, průjem a svalový třes (Simon, & Keenaghan, 2022).
Bad trip = jedná se o slangové označení negativního psychického stavu po užití psychedelik, který je doprovázen celou řadou psychických symptomů jako je úzkost, paranoia, dezorganizace myšlenek a smrt ega.
Empatogen / entaktogen = jedná se o skupinu psychotropních látek, které navozují silný pocit empatie a interpersonální sounáležitosti, a které také zesilují dotekové (taktilní) vjemy. Typickými zástupci této látkové kategorie jsou 3,4-methylendioxy-metamfetamin (MDMA) neboli extáze a 3,4-methylendioxy-amfetamin (MDA) (Shulgin, & Shulgin, 2013; Nichols, 2022).
DOx = tato zkratka odkazuje na sérii syntetických derivátů amfetaminu, které disponují psychedelickými a stimulačními účinky (Shulgin, & Shulgin, 2013; Nichols, 2016).
2Cx = tato zkratka odkazuje na sérii syntetických derivátů fenylethylaminů, které disponují psychedelickými a stimulačními účinky (Shulgin, & Shulgin, 2013; Nichols, 2016).
25x-NBOMe = tato zkratka odkazuje na sérii syntetických derivátů fenylethylaminů, které disponují psychedelickými a stimulačními účinky (Shulgin, & Shulgin, 2013; Nichols, 2016).
aMT = alpha-methyltryptamin – jedná se o syntetický derivát tryptaminu, který oplývá stimulačními, empatogenními/entaktogenními a psychedelickými účinky (Wilcox, 2012; NCBI – aMT, 2022).
PCP = Phencyclidine (Fencyklidin) – jedná se o veterinární anestetikum s disociativními účinky, podobné ketaminu (Journey, & Bentley, 2022).
Tabulka interakcí
[table id=5 /]
Bezpečné užívání III
Symptomy předávkování
V této sekci, se zaměříme na symptomy předávkování. Stejně tak, jako v předešlé sekci této kapitoly, se zde zaměřím pouze na výčet nejprominentnějších symptomů.
Definice odborných termínů
- Centrální nervová soustava
Mentální hyperstimulace – psychický stav způsobený nadměrnou aktivitou monoaminových drah mozku, který se projevuje silným pocitem bdělosti, neklidu, úzkosti a zrychleným tokem myšlenek (Vasan & Olango, 2022).
Agitace – psychická stav charakterizovaný pocitem neklidu a úzkosti (Siddiqui et al., 2022).
Hyperreflexie – neurologický symptom, který se projevuje nadměrnými svalovými reflexy (NCBI – Hyperreflexia, 2022).
Tremor – neurologický symptom projevující se neúmyslnými a rytmickými svalovými pohyby, které se vyskytují na jedné nebo více částech těla (Agarwal, & Biagioni, 2022).
Akutní toxická psychóza – psychický stav způsobený nadměrnou aktivací excitačních drah mozku (dopaminergní, noradrenergní, a glutamatergní) amfetaminem, který se projevuje celou řadou psychických symptomů včetně bludů, paranoie a agresivního chování (Fiorentini et al., 2021).
Adrenergní šok – psychosomatický stav, který je vyvolán náhlým zvýšením hladiny adrenalinu a noradrenalinu. Symptomy tohoto stavu mohou zahrnovat zvýšenou činnost srdce, srdeční arytmie, rapidní a extrémní zvýšení krevního tlaku, zástavu srdce, mrtvici, mánii, agresivní chování a delirium (King et al., 2018; Vasan & Olango, 2022).
2. Kardiovaskulární soustava
Hypertenze – vysoký krevní tlak (nad 130/80) (Iqba, & Jamal, 2022).
Hypotenze – nízký krevní tlak (pod 90/60) (Sharma et al., 2022).
Srdeční palpitace – pocit vnímatelného bušení srdce (Goyal et al., 2022).
Kardiogenní šok – fyziologický stav, který se projevuje neschopností srdce pumpovat dostatečné množství krve do oběhové soustavy. Příčinou tohoto stavu může být poškození komor srdce v důsledku akutního infarktu myokardu (srdeční svalovina) (Kosaraju et al., 2022).
Intracerebrální krvácení – krvácení do mozku (mrtvice) (Tadi & Lui, 2022).
Selhání oběhové soustavy – částečné nebo úplné selhání kardiovaskulární soustavy. Tento stav bývá nejčastěji způsoben zástavou srdce (Malik et al., 2022).
3. Muskuloskeletální soustava
Rabdomyolýza – fyziologický stav, při kterém dochází k poškození svalových buněk a uvolnění jejich obsahu do krevní plazmy (Stanley et al., 2022).
Svalové konvulze – svalové křeče (Bordoni et al., 2022).
4. Respirační soustava
Tachypnoe – zrychlená dechová frekvence (Park, & Khattar, 2022).
Plicní edém – otok plic (Malek, & Soufi, 2022).
Plicní hypertenze – abnormální vzestup krevního tlaku v plicních cévách (Oldroyd et al., 2022).
Respirační alkalóza – stav způsobený nadměrně silným dýcháním při kterém dochází k růstu zásaditosti tělesných tekutin v oblasti plic (Oldroyd et al., 2022).
5. Trávicí a vylučovací soustava
Nauzea – nevolnost, pocit na zvracení (Maule, 1990).
Retence moči – zadržení moči, neschopnost se vymočit (Serlin et al., 2018).
Anurie – pokles vylučování moči, často se jedná o symptom selhání ledvin (NCBI – Anuria, 2022).
Akutní renální selhání – akutní selhání ledvin (Bindroo et al., 2022; Goyal et al., 2022).
6. Ostatní symptomy postihující jiné soustavy
Mydriáza – rozšíření zorniček (NCBI – Mydriasis, 2022).
Diaforéza – nadměrné pocení (Brackenrich, & Fagg, 2022).
Hyperkalemie – zvýšená hladina draslíku v krvi (Simon et al., 2022).
Hypokalemie – snížení hladina draslíku v krvi (Castro, & Sharma, 2022).
Hyperpyrexie – zvýšená tělesná teplota nad 40 °C, která není regulována CNS – hypothalamem (na rozdíl od klasické horečky) (Balli et al., 2022).
Metabolická acidóza – fyziologický stav, při kterém dochází k poklesu koncentrace hydrogenuhličitanů pod referenční hodnoty (Burger, & Schaller, 2022).
Tabulka symptomů předávkování postihující různé soustavy těla
[table id=6 /]
Bezpečné užívání IV
Léčba předávkování I – první pomoc
Nyní se v rychlosti podíváme na první pomoc v případě předávkování. Stejně tak, jako v případě jiných krizových situací, je nutné okamžitě zavolat záchrannou službu. Poté je nutné zajistit:
- Přísun tekutin (ideálně čistá voda) aby se zabránilo dehydrataci. Zde však pozor, amfetamin má antidiuretické účinky (je schopný zvýšit hladinu antidiuretického hormonu), takže je důležité to s hydratací nepřehánět, aby nedošlo k vodní toxicitě (otrava vodou) (Lesnik, 1970; Docherty, & Alsufyani, 2021; Osborn et al., 2022).
- V případě výskytu závažné hypertermie (projevuje se silným pocením), je nutné snížit tělesnou teplotu studeným obkladem tak aby se předešlo vyčerpání organismu v důsledku zvýšené tělesné teploty (projevuje se teplou, suchou a zčervenalou pokožkou – může být smrtelné) (NHS, 2022; Osborn et al., 2022; Wasserman et al., 2021).
- Pokud dojde k projevům psychických symptomů předávkování jako je mentální hyperstimulace, úzkost, podrážděnost, agresivita a panika, tak je nutné pokusit se dotyčnou osobu uklidnit (Osborn et al., 2022).
- Pokuste se pomocí otevřených otázek, od dotyčného zjistit, jaký amfetamin byl užit (jestli klasický amfetamin nebo metamfetamin/pervitin), kdy a v jakém množství. Tyto informace poté sdělte členům záchranné služby. Při navazování verbálního kontaktu používejte neutrální tón, a to i v případě, že se intoxikovaná osoba chová nepřátelsky, mohlo by totiž dojít k eskalaci agresivního chování (Osborn et al., 2022).
- Dojde-li k projevům epilepsie, tak odstraňte veškeré nebezpečné předměty v bezprostředním okolí a po odeznění křečí, otočte dotyčnou osobu na bok do stabilizované polohy a případně zajistěte volný přístup dýchacím cestám a zkontrolujte životní funkce (dýchání a tep) (NHS, 2022; Osborn et al., 2022).
Léčba předávkování II – léčba v nemocnici
Screening
V nemocnici se zpravidla provádí lékařský screening, který slouží k celkové evaluaci stavu pacienta a upřesnění diagnózy na základě které se odvíjí následná léčba (Vasan & Olango, 2022).
Těžké předávkování Závažné symptomy | Laboratorní analýza Vyšetření krevního obrazu a metabolického panelu, kontrola hladiny kreatinkinázy v krvi (zvýšená hladina = rabdomyolýza), analýza moči (kvůli dalším látkám) | Další testy Rentgen hrudníku a EKG srdce (pokud pacienta bolí hrudník a má palpitace), CT hlavy (pokud pacienta bolí hlava, nebo pokud má/měl epileptické záchvaty) |
Lehké předávkování Mírné symptomy | Komplexní laboratorní analýza není nutná. Občasně se ale provádí analýza moči, kvůli přítomnosti dalších látek. | Kardiovaskulární testy a CT hlavy, se v tomto případě, zpravidla neprovádí. Občasně se ale měří krevní tlak. |
Léčba předávkování III – léčba v nemocnici
Léčba
Vzhledem k tomu, že na otravu amfetaminem neexistuje žádná protilátka, tak je následná léčba v nemocnici čistě symptomatická. Tedy, je nutné čekat a průběžně monitorovat stav pacienta, dokud tělo amfetamin nezpracuje a nevyloučí. Tabulka níže znázorňuje léčbu symptomů, které postihují zmíněné tělesné soustavy (Vasan & Olango, 2022).
[table id=7 /]
Reference
Acevedo, S. F., Pfankuch, T., van Meer, P., & Raber, J. (2008). Role of histamine in short- and long-term effects of methamphetamine on the developing mouse brain. Journal of neurochemistry, 107(4), pp. 976–986. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3172696/
Addisona, M., Kaner, E., Spencer, L., McGovern, W., McGover, R., Gilvarry, E., & O’Donnell, A. (2020). Exploring pathways into and out of amphetamine type stimulant use at critical turning points: a qualitative interview study. Health Sociology Reviews, 30(2), pp. 111-126. https://www.tandfonline.com/doi/full/10.1080/14461242.2020.1811747
Agarwal, S., & Biagioni, M. C. (2022). Essential Tremor. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing. https://www.ncbi.nlm.nih.gov/books/NBK499986/
Ahdut-Hacohen, R., Duridanova, D., Meiri, H., & Rahamimoff, R. (2004). Hydrogen ions control synaptic vesicle ion channel activity in Torpedo electromotor neurons. The Journal of physiology, 556(2), pp. 347–352. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1664946/
Ahn, K. H., Sewell, A., Elander, J., Pittman, B., Ranganathan, M., Gunduz-Bruce, H., Krystal, J., & D’Souza, D. C. (2015). Role of GABA Deficit in Sensitivity to the Psychotomimetic Effects of Amphetamine. Neuropsychopharmacology: official publication of the American College of Neuropsychopharmacology, 40(12), pp. 2822–2831. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4864658/
Allen, A., & Ely, R. (2009). Review: Synthetic Methods for Amphetamine (PDF). Northwest Association of Forensic Scientists, 37(2), pp 15–25. http://www.nwafs.org/newsletters/SyntheticAmphetamine.pdf
Alshak, M. N., & Das, J. M. (2022). Neuroanatomy, Sympathetic Nervous System. [Updated 2022 May 14]. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing. https://www.ncbi.nlm.nih.gov/books/NBK542195/
Althobaiti, Y. S., & Sari, Y. (2016). Alcohol Interactions with Psychostimulants: An Overview of Animal and Human Studies. Journal of addiction research & therapy, 7(3), pp. 281. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4966675/
American Addiction Center (AAC). (2022). Amphetamine Addiction: Symptoms, Side Effects & Treatment. https://americanaddictioncenters.org/amphetamine#:~:text=The%202015%20National%20Survey%20on,that%20is%2012%20and%20older
Angoorani, H., Narenjiha, H., Tayyebi, B., Ghassabian, A., Ahmadi, G., & Assari, S. (2012). Amphetamine use and its associated factors in body builders: a study from Tehran, Iran. Archives of medical science: AMS, 8(2), pp. 362–367. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3361051/
Ardito, F., Giuliani, M., Perrone, D., Troiano, G., & Lo Muzio, L. (2017). The crucial role of protein phosphorylation in cell signaling and its use as targeted therapy (Review). International journal of molecular medicine, 40(2), pp. 271–280. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5500920/
Arias-Carrión, O., Stamelou, M., Murillo-Rodríguez, E., Menéndez-González, M., & Pöppel, E. (2010). Dopaminergic reward system: a short integrative review. International archives of medicine, 3, pp. 24. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2958859/
Avery, M. C., & Krichmar, J. L. (2017). Neuromodulatory Systems and Their Interactions: A Review of Models, Theories, and Experiments. Frontiers in neural circuits, 11, pp. 108. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5744617/
Bagot, K. S., & Kaminer, Y. (2014). Efficacy of stimulants for cognitive enhancement in non-attention deficit hyperactivity disorder youth: a systematic review. Addiction (Abingdon, England), 109(4), pp. 547–557. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4471173/
Bahtiyar, S., Gulmez Karaca, K., Henckens, M., & Roozendaal, B. (2020). Norepinephrine and glucocorticoid effects on the brain mechanisms underlying memory accuracy and generalization. Molecular and cellular neurosciences, 108. https://pubmed.ncbi.nlm.nih.gov/32805389/
Bakshi, A., & Tadi, P. (2021). Biochemistry, Serotonin. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing. https://www.ncbi.nlm.nih.gov/books/NBK560856/
Balli, S., Shumway, K. R., & Sharan, S. (2022). Physiology, Fever. In: StatPearls [Internet]. Treasure Island (FL). https://www.ncbi.nlm.nih.gov/books/NBK562334/
Bamalan, O. A., Moore, M. J., & Khalili, Y. A. (2022). Physiology, Serotonin. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing. https://www.ncbi.nlm.nih.gov/books/NBK545168/
Barker-Haliski, M., & White, H. S. (2015). Glutamatergic Mechanisms Associated with Seizures and Epilepsy. Cold Spring Harbor perspectives in medicine, 5(8). https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4526718/
Barnes, A. J., Smith, M. L., Kacinko, S. L., Schwilke, E. W., Cone, E. J., Moolchan, E. T., & Huestis, M. A. (2008). Excretion of methamphetamine and amphetamine in human sweat following controlled oral methamphetamine administration. Clinical chemistry, 54(1), pp. 172–180. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2714868/
Bay-Richter, C., O’Callaghan, M. J., Mathur, N., O’Tuathaigh, C. M., Heery, D. M., Fone, K. C., Waddington, J. L., & Moran, P. M. (2013). D-amphetamine and antipsychotic drug effects on latent inhibition in mice lacking dopamine D2 receptors. Neuropsychopharmacology: official publication of the American College of Neuropsychopharmacology, 38(8), pp. 1512–1520. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3682146/
Berger, M., Gray, J. A., & Roth, B. L. (2009). The expanded biology of serotonin. Annual review of medicine, 60, pp. 355–366. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5864293/
Bermingham, D. P., & Blakely, R. D. (2016). Kinase-dependent Regulation of Monoamine Neurotransmitter Transporters. Pharmacological reviews, 68(4), pp. 888–953. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5050440/
Berridge K. C. (2009). Wanting and Liking: Observations from the Neuroscience and Psychology Laboratory. Inquiry (Oslo, Norway), 52(4), pp. 378. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2813042/
Berridge, K. C., & Kringelbach, M. L. (2015). Pleasure systems in the brain. Neuron, 86(3), pp. 646–664. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4425246/
Berridge, K. C., & Robinson, T. E. (2016). Liking, wanting, and the incentive-sensitization theory of addiction. The American psychologist, 71(8), pp. 670–679. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5171207/
Berridge, K. C., Robinson, T. E., & Aldridge, J. W. (2009). Dissecting components of reward: ‘liking’, ‘wanting’, and learning. Current opinion in pharmacology, 9(1), pp. 65–73. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2756052/
Bhatia, A., Lenchner, J.R., & Saadabadi, A. (2022). Biochemistry, Dopamine Receptors. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing. https://www.ncbi.nlm.nih.gov/books/NBK538242/
Bindroo, S., Rodriguez, Q., & Challa, H. J. (2022). Renal Failure. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing. https://www.ncbi.nlm.nih.gov/books/NBK519012/
Blackmore, C. G., Varro, A., Dimaline, R., Bishop, L., Gallacher, D. V., & Dockray, G. J. (2001). Measurement of secretory vesicle pH reveals intravesicular alkalinization by vesicular monoamine transporter type 2 resulting in inhibition of prohormone cleavage. The Journal of physiology, 531(3), pp. 605–617. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2278512/
Bordoni, B., Sugumar, K., & Varacallo, M. (2022). Muscle Cramps. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing. https://www.ncbi.nlm.nih.gov/books/NBK499895/
Brackenrich, J, & Fagg, C. (2022). Hyperhidrosis. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing. https://www.ncbi.nlm.nih.gov/books/NBK459227/
Bramness, J. G., Gundersen, Ø. H., Guterstam, J., Rognli, E. B., Konstenius, M., Løberg, E. M., Medhus, S., Tanum, L., & Franck, J. (2012). Amphetamine-induced psychosis–a separate diagnostic entity or primary psychosis triggered in the vulnerable? BMC psychiatry, 12, pp. 221. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3554477/
Brams, M., Mao, A. R., & Doyle, R. L. (2008). Onset of efficacy of long-acting psychostimulants in pediatric attention-deficit/hyperactivity disorder. Postgraduate medicine, 120(3), pp. 69–88. https://doi.org/10.3810/pgm.2008.09.1909
Briguglio, M., Dell’Osso, B., Panzica, G., Malgaroli, A., Banfi, G., Zanaboni Dina, C., Galentino, R., & Porta, M. (2018). Dietary Neurotransmitters: A Narrative Review on Current Knowledge. Nutrients, 10(5), pp. 591. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5986471/
Bruijnzeel A. W. (2009). kappa-Opioid receptor signaling and brain reward function. Brain research reviews, 62(1), pp. 127–146. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2787673/
Burger, M. K., & Schaller, D. J. (2022). Metabolic Acidosis. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing. https://www.ncbi.nlm.nih.gov/books/NBK482146/
Burchett, S. A., & Hicks, P. T. (2006). The mysterious trace amines: Protean neuromodulators of synaptic transmission in mammalian brain. Progress in Neurobiology, 79(5-6), pp. 223-246. https://www.sciencedirect.com/science/article/pii/S0301008206000827?via%3Dihub#!
Caire, M.J., Reddy, V., & Varacallo, M. (2022). Physiology, Synapse. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing. https://www.ncbi.nlm.nih.gov/books/NBK526047/
Cascorbi, I. (2012). Drug interactions–principles, examples and clinical consequences. Deutsches Arzteblatt international, 109(33-34), pp. 546–556. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3444856/
Castro, D. C., & Berridge, K. C. (2014). Opioid hedonic hotspot in nucleus accumbens shell: mu, delta, and kappa maps for enhancement of sweetness “liking” and “wanting”. The Journal of neuroscience: the official journal of the Society for Neuroscience, 34(12), pp. 4239–4250. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3960467/
Castro, D., & Sharma, S. (2022). Hypokalemia. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing. https://www.ncbi.nlm.nih.gov/books/NBK482465/
Cervantes, M. C., & Delville, Y. (2009). Serotonin 5-HT1A and 5-HT3 receptors in an impulsive-aggressive phenotype. Behavioral neuroscience, 123(3), pp. 589–598. https://pubmed.ncbi.nlm.nih.gov/19485565/
Ciranna, L. (2006). Serotonin as a modulator of glutamate- and GABA-mediated neurotransmission: implications in physiological functions and in pathology. Current neuropharmacology, 4(2), pp. 101–114. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2430669/
Colasanti, A., Searle, G. E., Long, C. J., Hill, S. P., Reiley, R. R., Quelch, D., Erritzoe, D., Tziortzi, A. C., Reed, L. J., Lingford-Hughes, A. R., Waldman, A. D., Schruers, K. R., Matthews, P. M., Gunn, R. N., Nutt, D. J., & Rabiner, E. A. (2012). Endogenous opioid release in the human brain reward system induced by acute amphetamine administration. Biological psychiatry, 72(5), pp. 371–377. https://pubmed.ncbi.nlm.nih.gov/22386378/
Coleman, J. J., & Pontefract, S. K. (2016). Adverse drug reactions. Clinical medicine (London, England), 16(5), pp. 481–485. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6297296/
Combo trip sit me (2022). Drug Combinations. https://combo.tripsit.me/
Cooper, G. M. (2000). The Cell: A Molecular Approach. 2nd edition. Sunderland (MA): Sinauer Associates. Transport of Small Molecules. https://www.ncbi.nlm.nih.gov/books/NBK9847/
Crummy, E. A., O’Neal, T. J., Baskin, B. M., & Ferguson, S. M. (2020). One Is Not Enough: Understanding and Modeling Polysubstance Use. Frontiers in neuroscience, 14, pp. 569. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7309369/
Cullen, J.M., & Cascella, M. (2022). Physiology, Enkephalin. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing. https://www.ncbi.nlm.nih.gov/books/NBK557764/
Daberkow, D. P., Brown, H. D., Bunner, K. D., Kraniotis, S. A., Doellman, M. A., Ragozzino, M. E., Garris, P. A., & Roitman, M. F. (2013). Amphetamine paradoxically augments exocytotic dopamine release and phasic dopamine signals. The Journal of neuroscience: the official journal of the Society for Neuroscience, 33(2), pp. 452–463. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3711765/
Daldegan-Bueno, D., Maia, L. O., Glass, M., Jutras-Aswad, D., & Fischer, B. (2022). Co-exposure of cannabinoids with amphetamines and biological, behavioral and health outcomes: a scoping review of animal and human studies. Psychopharmacology, 239(5), https://link.springer.com/chapter/10.1007/978-1-4939-2294-9_16#Bib1
Danielsson, K., Stomberg, R., Adermark, L., Ericson, M., & Söderpalm, B. (2021). Differential dopamine release by psychosis-generating and non-psychosis-generating addictive substances in the nucleus accumbens and dorsomedial striatum. Translational psychiatry, 11(1), pp. 472. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8438030/
de Boer, S. F., & Koolhaas, J. M. (2005). 5-HT1A and 5-HT1B receptor agonists and aggression: a pharmacological challenge of the serotonin deficiency hypothesis. European journal of pharmacology, 526(1-3), pp. 125–139. https://pubmed.ncbi.nlm.nih.gov/16310183/
de la Torre, R., Farré, M., Navarro, M., Pacifici, R., Zuccaro, P., & Pichini, S. (2004). Clinical pharmacokinetics of amphetamine and related substances: monitoring in conventional and non-conventional matrices. Clinical pharmacokinetics, 43(3), pp. 157–185. https://pubmed.ncbi.nlm.nih.gov/14871155/
de la Torre, R., Yubero-Lahoz, S., Pardo-Lozano, R., & Farré, M. (2012). MDMA, methamphetamine, and CYP2D6 pharmacogenetics: what is clinically relevant? Frontiers in genetics, 3, pp. 235. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3495276/
Defalque, R.J. & Amos, W. (2011). Methamphetamine for Hitler’s Germany: 1937 to 1945. Bulletin of Anesthesia History, 29(2), pp. 21-24, 32. https://www.sciencedirect.com/science/article/abs/pii/S1522864911500162?via%3Dihub
Desrochers, S. S., Spring, M. G., & Nautiyal, K. M. (2022). A Role for Serotonin in Modulating Opposing Drive and Brake Circuits of Impulsivity. Frontiers in behavioral neuroscience, 16, pp. 791-749. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8892181/
Dias da Silva, D., Carmo, H., & Silva, E. (2013). The risky cocktail: what combination effects can we expect between ecstasy and other amphetamines? Archives of toxicology, 87(1), pp. 111–122. https://doi.org/10.1007/s00204-012-0929-9
Dodd, S., F Carvalho, A., Puri, B. K., Maes, M., Bortolasci, C. C., Morris, G., & Berk, M. (2021). Trace Amine-Associated Receptor 1 (TAAR1): A new drug target for psychiatry? Neuroscience and biobehavioral reviews, 120, pp. 537–541. https://pubmed.ncbi.nlm.nih.gov/33031817/
Docherty, J. R., & Alsufyani, H. A. (2021). Pharmacology of Drugs Used as Stimulants. Clinical Pharmacology, 61(2), pp. 53-69. https://accp1.onlinelibrary.wiley.com/doi/10.1002/jcph.1918
Downs, A. M., & McElligott, Z. A. (2022). Noradrenergic circuits and signaling in substance use disorders. Neuropharmacology, 208. https://pubmed.ncbi.nlm.nih.gov/35176286/
Drug bank (a). (2022) Amphetamine. https://go.drugbank.com/drugs/DB00182
Drug bank (b). (2022) Hydroxyamphetamine. https://go.drugbank.com/drugs/DB09352
Drug bank c. (2022) Phenylpropanolamine (Norephedrine). https://go.drugbank.com/drugs/DB00397
Drug bank. (2022). Cocaine. https://go.drugbank.com/drugs/DB00907
Drugs.com. (2022) Drug Interactions between Adderall and Zoloft. https://www.drugs.com/drug-interactions/adderall-with-zoloft-190-1645-2057-1348.html?professional=1
Drugs.com. (2022). Amphetamine Interactions. https://www.drugs.com/drug-interactions/amphetamine.html
Drugs.com. (2022). Amphetamine. https://www.drugs.com/amphetamine.html
Duman, R. S., & Nestler, E. J. (1999). Adenylyl Cyclases. In: G. J. Siegel, B. W. Agranoff, R. W. Albers, & et al., editors. Basic Neurochemistry: Molecular, Cellular and Medical Aspects (6th ed). Philadelphia: Lippincott-Raven. https://www.ncbi.nlm.nih.gov/books/NBK27958/
Edeleano, L. (1887). Über einige Derivate der Phenylmethacrylsäure und der Phenylisobuttersäure. Berichte der Deutschen Chemischen Gesellschaft, 20(1), pp. 616–622. https://gallica.bnf.fr/ark:/12148/bpt6k90709v/f619.image.langDE?pageNumber=616
Edström, B. (2015). The forgotten success story: Japan and the methamphetamine problem. Japan Forum, 27(4). https://www.tandfonline.com/doi/abs/10.1080/09555803.2015.1024710?journalCode=rjfo20
Eiden, L. E., & Weihe, E. (2011). VMAT2: a dynamic regulator of brain monoaminergic neuronal function interacting with drugs of abuse. Annals of the New York Academy of Sciences, 1216, pp. 86–98. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4183197/
Erowid. (2020). Amphetamine vault. https://erowid.org/chemicals/amphetamines/amphetamines.shtml
European Monitoring Center for Drugs and Drug Addiction (EMCDDA). (2021). Evropská zpráva o drogách: trendy a vývoj. https://www.emcdda.europa.eu/system/files/publications/13838/2021.2256_CS0906.pdf
European Monitoring Center for Drugs and Drug Addiction (EMCDDA). (2020). Infographic: MDMA samples tested by drug checking services between January and June 2019. https://www.emcdda.europa.eu/media-library/infographic-mdma-samples-tested-drug-checking-services-between-january-and-june-2019_en
European Monitoring Center for Drugs and Drug Addiction (EMCDDA). (2014). European Drug Report. https://www.emcdda.europa.eu/attachements.cfm/att_228272_EN_TDAT14001ENN.pdf
European Monitoring Center for Drugs and Drug Addiction (EMCDDA). (2018). Statistical Bulletin 2018: prevalence of drug use. https://www.emcdda.europa.eu/data/stats2018/gps_en
European Monitoring Center for Drugs and Drug Addiction (EMCDDA). (2022). Europe’s emergence as a globally important producer of methamphetamine. https://www.emcdda.europa.eu/publications/eu-drug-markets/methamphetamine/europe-as-a-global-producer_en
European Monitoring Center for Drugs and Drug Addiction (EMCDDA, a). (2022). Amphetamine Drug Profile. https://www.emcdda.europa.eu/publications/drug-profiles/amphetamine_en
European Monitoring Center for Drugs and Drug Addiction (EMCDDA, b). (2022). Cocaine Drug Profile. https://www.emcdda.europa.eu/publications/drug-profiles/cocaine_en
European Monitoring Center for Drugs and Drug Addiction (EMCDDA, c). (2022). Czechia, Country Drug Report 2019. https://www.emcdda.europa.eu/system/files/publications/11339/czechia-cdr-2019_0.pdf
European Monitoring Center for Drugs and Drug Addiction (EMCDDA, d). (2022). Methamphetamine drug profile. https://www.emcdda.europa.eu/publications/drug-profiles/methamphetamine_en
Faure, A., Richard, J. M., & Berridge, K. C. (2010). Desire and dread from the nucleus accumbens: cortical glutamate and subcortical GABA differentially generate motivation and hedonic impact in the rat. PloS one, 5(6). https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2887893/
Feio-Azevedo, R., Costa, V. M., Ferreira, L. M., Branco, P. S., Pereira, F. C., Bastos, M. L., Carvalho, F., & Capela, J. P. (2017). Toxicity of the amphetamine metabolites 4-hydroxyamphetamine and 4-hydroxy-norephedrine in human dopaminergic differentiated SH-SY5Y cells. Toxicology letters, 269, pp. 65–76. https://pubmed.ncbi.nlm.nih.gov/28115274/
Ferrucci, M., Limanaqi, F., Ryskalin, L., Biagioni, F., Busceti, C. L., & Fornai, F. (2019). The Effects of Amphetamine and Methamphetamine on the Release of Norepinephrine, Dopamine and Acetylcholine From the Brainstem Reticular Formation. Frontiers in neuroanatomy, 13, pp. 48. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6524618/
Fiorentini, A., Cantù, F., Crisanti, C., Cereda, G., Oldani, L., & Brambilla, P. (2021). Substance-Induced Psychoses: An Updated Literature Review. Frontiers in psychiatry, 12. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8732862/
Fischer, A. G., & Ullsperger, M. (2017). An Update on the Role of Serotonin and its Interplay with Dopamine for Reward. Frontiers in human neuroscience, 11, pp. 484. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5641585/
Fitzgerald, P. A. (2011). Chapter 11. Adrenal Medulla and Paraganglia. In D.G. Gardner, & D., Shoback, (eds.). Greenspan’s Basic & Clinical Endocrinology (9th ed.). New York: McGraw-Hill.
Fluyau, D., Mitra, P., & Lorthe, K. (2019). Antipsychotics for Amphetamine Psychosis. A Systematic Review. Frontiers in Psychiatry. https://www.frontiersin.org/articles/10.3389/fpsyt.2019.00740/full
Fog, J. U., Khoshbouei, H., Holy, M., Owens, W. A., Vaegter, C. B., Sen, N., Nikandrova, Y., Bowton, E., McMahon, D. G., Colbran, R. J., Daws, L. C., Sitte, H. H., Javitch, J. A., Galli, A., & Gether, U. (2006). Calmodulin kinase II interacts with the dopamine transporter C terminus to regulate amphetamine-induced reverse transport. Neuron, 51(4), pp. 417–429. https://pubmed.ncbi.nlm.nih.gov/16908408/
Foster, J. D., & Vaughan, R. A. (2017). Phosphorylation mechanisms in dopamine transporter regulation. Journal of chemical neuroanatomy, 83-84, pp. 10–18. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6705611/
Fregonese, M., Albino, A., Covino, C., Gili, A., Bacci, M., Nicoletti, A., & Gambelunghe, C. (2021). Drug Checking as Strategy for Harm Reduction in Recreational Contests: Evaluation of Two Different Drug Analysis Methodologies. Frontiers in psychiatry, 12, 596895. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7938318/
Freyberg, Z., Sonders, M. S., Aguilar, J. I., Hiranita, T., Karam, C. S., Flores, J., Pizzo, A. B., Zhang, Y., Farino, Z. J., Chen, A., Martin, C. A., Kopajtic, T. A., Fei, H., Hu, G., Lin, Y. Y., Mosharov, E. V., McCabe, B. D., Freyberg, R., Wimalasena, K., Hsin, L. W., Javitch, J. A. & et al. (2016). Mechanisms of amphetamine action illuminated through optical monitoring of dopamine synaptic vesicles in Drosophila brain. Nature communications, 7. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4757768/
Friedman, M. (2018). Analysis, Nutrition, and Health Benefits of Tryptophan. International journal of tryptophan research: IJTR, 11. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6158605/
Gainetdinov, R. R., Hoener, M. C., & Berry, M. D. (2018). Trace Amines and Their Receptors. Pharmacological reviews, 70(3), pp. 549–620. https://pubmed.ncbi.nlm.nih.gov/29941461/
Gal, J. (1982). Amphetamine in Nasal Inhalers. Journal of Toxicology; Clinical Toxicology, 19(5), pp. 517-518. https://www.researchgate.net/publication/238256801_Amphetamines_in_Nasal_Inhalers
Gilani, B., & Cassagnol, M. (2022). Biochemistry, Cytochrome P450. Treasure Island (FL): StatPearls Publishing. https://www.ncbi.nlm.nih.gov/books/NBK557698/
Glennon, R. A. (2013). Phenylisopropylamine stimulants: amphetamine-related agents. In T. L., Lemke, D. A., Williams, V. F., Roche, & W. Zito, (eds.). Foye’s principles of medicinal chemistry (7th ed.). Philadelphia, USA: Wolters Kluwer Health/Lippincott Williams & Wilkins. pp. 646–648. https://books.google.cz/books?id=Sd6ot9ul-bUC&pg=PA646&redir_esc=y#v=onepage&q&f=false
Goyal, A., Daneshpajouhnejad, P., Hashmi, M. F., & et al. (2022). Acute Kidney Injury. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing. https://www.ncbi.nlm.nih.gov/books/NBK441896/
Goyal, A., Robinson, K. J., Katta, S., & et al. (2022). Palpitation. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing. https://www.ncbi.nlm.nih.gov/books/NBK436016/
Grandy, D. K. (2007). Trace amine-associated receptor 1-Family archetype or iconoclast? Pharmacology & therapeutics, 116(3), pp. 355–390. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2767338/
Greene, S. L., Kerr, F., & Braitberg, G. (2008). Review article: amphetamines and related drugs of abuse. Emergency medicine Australasia: EMA, 20(5), pp. 391–402. https://onlinelibrary.wiley.com/doi/10.1111/j.1742-6723.2008.01114.x
Grobler, S. R., Chikte, U., & Westraat, J. (2011). The pH Levels of Different Methamphetamine Drug Samples on the Street Market in Cape Town. ISRN dentistry. https://doi.org/10.5402/2011/974768
Gupta, M., Bailey, S., & Lovato, L. M. (2009). Bottoms up: methamphetamine toxicity from an unusual route. The western journal of emergency medicine, 10(1), pp. 58–60. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2672287/
Gupta, R. C. (2012). Veterinary Toxicology: Basic and Clinical Principles. Academic Press. pp. 458. https://books.google.cz/books?id=OG_Oz58xq6kC&pg=PA458&redir_esc=y#v=onepage&q&f=false
Guterstam, J., Jayaram-Lindström, N., Cervenka, S., Frost, J. J., Farde, L., Halldin, C., & Franck, J. (2013). Effects of amphetamine on the human brain opioid system–a positron emission tomography study. The international journal of neuropsychopharmacology, 16(4), pp. 763–769. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3622172/
Hafiz, S., & De Jesus, O. (2022). Ataxia. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing. https://www.ncbi.nlm.nih.gov/books/NBK562284/
Hamill, R. W., Shapiro, R. E., & Vizzard, M. A. (2012). Peripheral Autonomic Nervous System. In D. Robertson, I. Biaggioni & et al. (eds.). Primer on the Autonomic Nervous System. Academic Press. pp. 17–20.
Harm Reduction International (HRI). (2019). Harm Reduction for Stimulant Use; Briefing paper. https://www.hri.global/files/2019/04/28/harm-reduction-stimulants-coact.pdf
Harm Reduction Tip Sheet for Workers (HRTSW). (2022). Amphetamines. https://www.mhc.wa.gov.au/media/3465/harm-reduction-tip-sheet-for-workers-amphetamines-2020.pdf
Harris, D. S., & Sequera, G. (2003). The Bioavailability of Intranasal and Smoked Methamphetamine. Clinical Pharmacology & Therapeutics 74(5), pp. 475-86. https://www.researchgate.net/publication/9034481_The_Bioavailability_of_Intranasal_and_Smoked_Methamphetamine
Hasenhuetl, P. S., Bhat, S., Freissmuth, M., & Sandtner, W. (2019). Functional Selectivity and Partial Efficacy at the Monoamine Transporters: A Unified Model of Allosteric Modulation and Amphetamine-Induced Substrate Release. Molecular pharmacology, 95(3), pp. 303–312. https://molpharm.aspetjournals.org/content/95/3/303
Heal, D. J., Smith, S. L., Gosden, J., & Nutt, D. J. (2013). Amphetamine, past and present: a pharmacological and clinical perspective. Journal of Pharmacology, 27(6), pp. 479–496. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3666194/
Healthline. (2022). Can You Overdose on Adderall? https://www.healthline.com/health/can-you-overdose-on-adderall
Hendrickson, H. P., Hardwick, W. C., McMillan, D. E., & Owens, S. M. (2008). Bioavailability of (+)-methamphetamine in the pigeon following an intramuscular dose. Pharmacology, biochemistry, and behavior, 90(3), pp. 382–386. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2736803/
Horwitz, H., Skanning, P., Askaa, B., & Jürgens, G. (2014). Amphetamine abuse and drug interactions. Ugeskrift for laeger, 176(45). https://pubmed.ncbi.nlm.nih.gov/25394841/
Hou, Y., & Wu, G. (2017). Nutritionally Nonessential Amino Acids: A Misnomer in Nutritional Sciences. Advances in nutrition (Bethesda, Md.), 8(1), pp. 137–139. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5227973/
Hussain, L. S., Reddy, V., & Maani, C. V. (2022). Physiology, Noradrenergic Synapse. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing. https://www.ncbi.nlm.nih.gov/books/NBK540977/
Chambers, S. A., DeSousa, J. M., Huseman, E. D., & Townsend, S. D. (2018). The DARK Side of Total Synthesis: Strategies and Tactics in Psychoactive Drug Production. ACS chemical neuroscience, 9(10), pp. 2307–2330. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6205722/
Chanaday, N. L., Cousin, M. A., Milosevic, I., Watanabe, S., & Morgan, J. R. (2019). The Synaptic Vesicle Cycle Revisited: New Insights into the Modes and Mechanisms. The Journal of neuroscience: the official journal of the Society for Neuroscience, 39(42), pp. 8209–8216. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6794917/
Chaudhry, S. R., & Gossman, W. (2022). Biochemistry, Endorphin. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing. https://www.ncbi.nlm.nih.gov/books/NBK470306/
Chem Europe. (2022). Amphetamin. https://www.chemeurope.com/en/encyclopedia/Amphetamine.html#_note-0/
Chen, R., Jäättelä, M., & Liu, B. (2020). Lysosome as a Central Hub for Rewiring PH Homeostasis in Tumors. Cancers, 12(9), 2437. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7565471/
Cho, H. U., Kim, S., Sim, J., Yang, S., An, H., Nam, M. H., Jang, D. P., & Lee, C. J. (2021). Redefining differential roles of MAO-A in dopamine degradation and MAO-B in tonic GABA synthesis. Experimental & molecular medicine, 53(7), pp. 1148–1158. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8333267/
Chu, A., & Wadhwa, R. (2022). Selective Serotonin Reuptake Inhibitors. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing. https://www.ncbi.nlm.nih.gov/books/NBK554406/
Ilieva, I. P., & Farah, M. J. (2013). Enhancement stimulants: perceived motivational and cognitive advantages. Frontiers in neuroscience, 7, pp. 198. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3813924/
Ilieva, I., Hook, C. J., & Farah, M. J. (2015). Prescription Stimulants’ Effects on Healthy Inhibitory Control, Working Memory, and Episodic Memory: A Meta-Analysis. Journal of Cognitive Neuroscience, 27(6), pp. 1069-1089. https://repository.upenn.edu/neuroethics_pubs/130/
Inchem. (1998). Amphetamine. https://inchem.org/documents/pims/pharm/pimg009.htm
Iqbal, A. M., & Jamal, S. F. (2022). Essential Hypertension. In: StatPearls [Internet]. Treasure
Island (FL): StatPearls Publishing. https://www.ncbi.nlm.nih.gov/books/NBK539859/
Jenkins, J. P. (2022). Methamphetamine. Britannica. https://www.britannica.com/science/methamphetamine
Jiao, D., Liu, Y., Li, X., Liu, J., & Zhao, M. (2015). The role of the GABA system in amphetamine-type stimulant use disorders. Frontiers in cellular neuroscience, 9, pp. 162. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4419710/
Journey, J. D., & Bentley, T. P. (2022). Phencyclidine Toxicity. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing. https://www.ncbi.nlm.nih.gov/books/NBK507865/
Olguín, J. H., Guzmán, C. D., García, H. E., & Mejía, B. G. (2016). The Role of Dopamine and Its Dysfunction as a Consequence of Oxidative Stress. Oxidative medicine and cellular longevity. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4684895/
Jutkiewicz, E. M., Nicolazzo, D. M., Kim, M. N., & Gnegy, M. E. (2008). Nicotine and amphetamine acutely cross-potentiate their behavioral and neurochemical responses in female Holtzman rats. Psychopharmacology, 200(1), pp. 93–103. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8009032/
Kamble, S. H., Sharma, A., King, T. I., Berthold, E. C., León, F., Meyer, P., Kanumuri, S., McMahon, L. R., McCurdy, C. R., & Avery, B. A. (2020). Exploration of cytochrome P450 inhibition mediated drug-drug interaction potential of kratom alkaloids. Toxicology letters, 319, pp. 148–154. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7902086/
King, A., Dimovska, M., & Bisoski, L. (2018). Sympathomimetic Toxidromes and Other Pharmacological Causes of Acute Hypertension. Current hypertension reports, 20(1), pp. 8. https://link.springer.com/article/10.1007/s11906-018-0807-9
Knoll, A. T., & Carlezon, W. A., Jr (2010). Dynorphin, stress, and depression. Brain research, 1314, pp. 56–73. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2819644/
Kosaraju, A., Pendela, V.S., & Hai, O. (2022). Cardiogenic Shock. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing. https://www.ncbi.nlm.nih.gov/books/NBK482255/
Krystal, J. H., Perry, E. B., Jr, Gueorguieva, R., Belger, A., Madonick, S. H., Abi-Dargham, A., Cooper, T. B., Macdougall, L., Abi-Saab, W., & D’Souza, D. C. (2005). Comparative and interactive human psychopharmacologic effects of ketamine and amphetamine: implications for glutamatergic and dopaminergic model psychoses and cognitive function. Archives of general psychiatry, 62(9), pp. 985–994. https://jamanetwork.com/journals/jamapsychiatry/fullarticle/1108408
Kuczenski, R., & Segal, D. S. (1997). Effects of methylphenidate on extracellular dopamine, serotonin, and norepinephrine: comparison with amphetamine. Journal of neurochemistry, 68(5), pp. 2032–2037. https://pubmed.ncbi.nlm.nih.gov/9109529/
Kudlak, M., & Tadi, P. (2022). Physiology, Muscarinic Receptor. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing. https://www.ncbi.nlm.nih.gov/books/NBK555909/
Lai, C. C., Lee, L. J., & Yin, H. S. (2013). Combinational effects of ketamine and amphetamine on behaviors and neurotransmitter systems of mice. Neurotoxicology, 37, pp. 136–143. https://pubmed.ncbi.nlm.nih.gov/23660488/
Lakhan, S. E., & Kirchgessner, A. (2012). Prescription stimulants in individuals with and without attention deficit hyperactivity disorder: misuse, cognitive impact, and adverse effects. Brain and Behavior, 2(5), pp. 661-667. https://onlinelibrary.wiley.com/doi/full/10.1002/brb3.78
Le Merrer, J., Becker, J. A., Befort, K., & Kieffer, B. L. (2009). Reward processing by the opioid system in the brain. Physiological reviews, 89(4), pp. 1379–1412. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4482114/
Ledonne, A., Berretta, N., Davoli, A., Rizzo, G. R., Bernardi, G., & Mercuri, N. B. (2011). Electrophysiological effects of trace amines on mesencephalic dopaminergic neurons. Frontiers in systems neuroscience, 5, pp. 56. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3131148/
Leśnik, H. (1970). Amphetamine-stimulated release of the antidiuretic hormone from cut infundibular axons of reserpinized rats. Bulletin de l’Academie polonaise des sciences. Serie des sciences biologiques, 18(1), pp. 59–61. https://pubmed.ncbi.nlm.nih.gov/5427943/
Lewin, A. H., Miller, G. M., & Gilmour, B. (2011). Trace amine-associated receptor 1 is a stereoselective binding site for compounds in the amphetamine class. Bioorganic & medicinal chemistry, 19(23), pp. 7044–7048. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3236098/
Li, M. H., Underhill, S. M., Reed, C., Phillips, T. J., Amara, S. G., & Ingram, S. L. (2017). Amphetamine and Methamphetamine Increase NMDAR-GluN2B Synaptic Currents in Midbrain Dopamine Neurons. Neuropsychopharmacology: official publication of the American College of Neuropsychopharmacology, 42(7), pp. 1539–1547. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5436114/
Li, Y., Lefever, M. R., Muthu, D., Bidlack, J. M., Bilsky, E. J., & Polt, R. (2012). Opioid glycopeptide analgesics derived from endogenous enkephalins and endorphins. Future medicinal chemistry, 4(2), pp. 205–226. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3306179/
Li, Z., Liang, Y., Boules, M., Gordillo, A., & Richelson, E. (2010). Effect of amphetamine on extracellular concentrations of amino acids in striatum in neurotensin subtype 1 and 2 receptor null mice: a possible interaction between neurotensin receptors and amino acid systems for study of schizophrenia. Neuropharmacology, 58(7), pp. 1174–1178. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2849927/
Liddle, D. G., & Connor, D. J. (2013). Nutritional supplements and ergogenic AIDS. Primary Care: Clinics in Office Practice, 40(2), pp. 487–505. https://www.sciencedirect.com/science/article/abs/pii/S0095454313000249?via%3Dihub
Lile, J. A., Babalonis, S., Emurian, C., Martin, C. A., Wermeling, D. P., & Kelly, T. H. (2011). Comparison of the behavioral and cardiovascular effects of intranasal and oral d-amphetamine in healthy human subjects. Journal of clinical pharmacology, 51(6), pp. 888–898. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3684273/
Liu, C., & Kaeser, P. S. (2019). Mechanisms and regulation of dopamine release. Current opinion in neurobiology, 57, pp. 46–53. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6629510/
Liu, J. F., & Li, J. X. (2018). TAAR1 in Addiction: Looking Beyond the Tip of the Iceberg. Frontiers in pharmacology, 9, pp. 279. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5881156/
Liu, J., Wu, R., & Li, J. X. (2020). TAAR1 and Psychostimulant Addiction. Cellular and molecular neurobiology, 40(2), pp. 229–238. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7845786/
Liu, X. B., Zhang, Y., Wang, X. Y., & Hao, W. (2017). The synergistic effect of dual use of amphetamine-type stimulants and ketamine on drug-induced psychotic symptoms in Chinese synthetic drug users. Oncotarget, 8(39), pp. 66569–66575. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5630437/
Lopez, M. J., & Mohiuddin, S. S. (2022). Biochemistry, Essential Amino Acids. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing. https://www.ncbi.nlm.nih.gov/books/NBK557845/
Maffei, M. E. (2020). 5-Hydroxytryptophan (5-HTP): Natural Occurrence, Analysis, Biosynthesis, Biotechnology, Physiology and Toxicology. International journal of molecular sciences, 22(1), pp. 181. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7796270/
Malek, R., & Soufi, S. (2022). Pulmonary Edema. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing. https://www.ncbi.nlm.nih.gov/books/NBK557611/
Malik, A., Brito, D., Vaqar, S., & et al. (2022). Congestive Heart Failure. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing. https://www.ncbi.nlm.nih.gov/books/NBK430873/
Marinelli, M., & McCutcheon, J. E. (2014). Heterogeneity of dopamine neuron activity across traits and states. Neuroscience, 282, pp. 176–197. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4312268/
Markowitz, J. S., & Patrick, K. S. (2017). The Clinical Pharmacokinetics of Amphetamines Utilized in the Treatment of Attention-Deficit/Hyperactivity Disorder. Journal of Child and Adolescent Psychopharmacology, 27(8). https://www.researchgate.net/publication/319769260_The_Clinical_Pharmacokinetics_of_Amphetamines_Utilized_in_the_Treatment_of_Attention-DeficitHyperactivity_Disorder
Martin, D., & Le, J. K. (2022). Amphetamine. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing. https://www.ncbi.nlm.nih.gov/books/NBK556103/
Maule, W. F. (1990). Nausea and Vomiting. Clinical Methods: The History, Physical, and Laboratory Examinations. 3rd edition. Boston: Butterworths, 84. https://www.ncbi.nlm.nih.gov/books/NBK410/
McCutcheon, R. A., Krystal, J. H., & Howes, O. D. (2020). Dopamine and glutamate in schizophrenia: biology, symptoms and treatment. World psychiatry: official journal of the World Psychiatric Association (WPA), 19(1), pp. 15–33. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6953551/
McDonnell, A. M., & Dang, C. H. (2013). Basic review of the cytochrome p450 system. Journal of the advanced practitioner in oncology, 4(4), pp. 263–268. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4093435/
Miller, G. M. (2011). The emerging role of trace amine-associated receptor 1 in the functional regulation of monoamine transporters and dopaminergic activity. Journal of neurochemistry, 116(2), pp. 164–176. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3005101/
Miyazaki, K., Miyazaki, K. W., & Doya, K. (2012). The role of serotonin in the regulation of patience and impulsivity. Molecular neurobiology, 45(2), pp. 213–224. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3311865/
Mohamed, W., Ben Hamadi, S., Cassel, J. C., & de Vasconcelos, A. P. (2011). MDMA: Interactions with other psychoactive drugs. Pharmacology, Biochemistry and behavior, 99(4), pp. 759-774. https://www.researchgate.net/publication/51492741_MDMA_Interactions_with_other_psychoactive_drugs
Mohan, J., & OSN. (2014). World Drug Report 2014. United Nations Office on Drugs and Crime. https://www.unodc.org/documents/wdr2014/World_Drug_Report_2014_web.pdf
Moncrieff, J., Cooper, R. E., Stockmann, T., Amendola, S., Hengartner, M. P., & Horowitz, M. A. (2022). The serotonin theory of depression: a systematic umbrella review of the evidence. Molecular Psychiatra 1(1). https://www.nature.com/articles/s41380-022-01661-0
Mongi-Bragato, B., Avalos, M. P., Guzmán, A. S., Bollati, F. A., & Cancela, L. M. (2018). Enkephalin as a Pivotal Player in Neuroadaptations Related to Psychostimulant Addiction. Frontiers in psychiatry, 9, pp. 222. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5985699/
Morales, I., & Berridge, K. C. (2020). ‘Liking’ and ‘wanting’ in eating and food reward: Brain mechanisms and clinical implications. Physiology & behavior, 227. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7655589/
Morelli, M., & Tognotti, E. (2021). Brief history of the medical and non-medical use of amphetamine-like psychostimulants. Experimental Neurology, 342. https://pubmed.ncbi.nlm.nih.gov/34000249/
Munzar, P., Tanda, G., Justinova, Z., & Goldberg, S. R. (2004). Histamine h3 receptor antagonists potentiate methamphetamine self-administration and methamphetamine-induced accumbal dopamine release. Neuropsychopharmacology: official publication of the American College of Neuropsychopharmacology, 29(4), pp. 705–717. https://pubmed.ncbi.nlm.nih.gov/14735131/
Musacchio, J.M. (2013). Chapter 1: Enzymes involved in the biosynthesis and degradation of catecholamines. In L. Iverson (ed.). Biochemistry of Biogenic Amines. Springer. pp. 1–35.
Musther, H., Olivares-Morales, A., Hatley, O. J., Liu, B., & Rostami Hodjegan, A. (2014). Animal versus human oral drug bioavailability: do they correlate? European journal of pharmaceutical sciences: official journal of the European Federation for Pharmaceutical Sciences, 57(100), pp. 280–291. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4107270/
Nakagawasai, O., Onogi, H., Mitazaki, S. & et al. (2012). Pharmacological actions of P-hydroxyamphetamine in the central nervous system. Methamphetamines: Abuse, Health, Effects and Treatment Options. https://www.researchgate.net/publication/285201862_Pharmacological_actions_of_P-hydroxyamphetamine_in_the_central_nervous_system
National Center for Biotechnology Information (NCBI) (2022). Phenethylamine. ttps://pubchem.ncbi.nlm.nih.gov/compound/Phenethylamine.
National Center for Biotechnology Information (NCBI). (2022). Alpha Methyltryptamine (aMT). https://pubchem.ncbi.nlm.nih.gov/compound/alpha-Methyltryptamine
National Center for Biotechnology Information (NCBI). (2022). Amphetamine. https://pubchem.ncbi.nlm.nih.gov/compound/Amphetamine#section=Henry’s-Law-Constant.
National Center for Biotechnology Information (NCBI). (2022). Anuria. https://www.ncbi.nlm.nih.gov/medgen/358
National Center for Biotechnology Information (NCBI). (2022). Cytosol. https://www.ncbi.nlm.nih.gov/mesh?Db=mesh&Cmd=DetailsSearch&Term=%22Cytosol%22%5BMeSH+Terms%5D
National Center for Biotechnology Information (NCBI). (2022). HTR1A 5-hydroxytryptamine receptor 1A (5HT1A) Homo sapiens (human). https://www.ncbi.nlm.nih.gov/gene/3350
National Center for Biotechnology Information (NCBI). (2022). Hyperreflexia. https://www.ncbi.nlm.nih.gov/medgen/57738
National Center for Biotechnology Information (NCBI). (2022). Mydriasis. https://www.ncbi.nlm.nih.gov/medgen/10145
National Center for Biotechnology Information (NCBI). (2022). Norepinephrine. https://pubchem.ncbi.nlm.nih.gov/compound/Norepinephrine
National Center for Biotechnology Information (NCBI). (2022). TAAR1 trace amine associated receptor 1 – Homo sapiens (human). https://www.ncbi.nlm.nih.gov/gene?Db=gene&Cmd=DetailsSearch&Term=134864
National Center for Biotechnology Information (NCBI). (2022). ADCY1 adenylate cyclase 1 – Homo sapiens (human). https://www.ncbi.nlm.nih.gov/gene/107
National Center for Biotechnology Information (NCBI, a). (2022). 4-(2-Aminopropyl)phenol (hydroxyamphetamine). National Library of Medicine. https://pubchem.ncbi.nlm.nih.gov/compound/4-_2-Aminopropyl_phenol
National Center for Biotechnology Information (NCBI, b). (2022). Amphetamine metabolism and metabolites. National Library of Medicine. https://pubchem.ncbi.nlm.nih.gov/compound/3007#section=Metabolism-Metabolites
National Center for Biotechnology Information (NCBI, c). (2022). P-hydroxynorephedrine. https://pubchem.ncbi.nlm.nih.gov/compound/p-HYDROXYNOREPHEDRINE#section=3D-Conformer
National Center for Biotechnology Information (NCBI, d). (2022). Phenylpropanolamine (Norefedrin). National Library of Medicine. https://pubchem.ncbi.nlm.nih.gov/compound/Phenylpropanolamine
National Health Service (NHS). (2022). Heat exhaustion and heatstroke. https://www.nhs.uk/conditions/heat-exhaustion-heatstroke/
National Health Service (NHS). (2022). What to do if someone has a seizure (fit). https://www.nhs.uk/conditions/what-to-do-if-someone-has-a-seizure-fit/
Nestler, E. J., & Greengard, P. (1999). Protein Phosphorylation is of Fundamental Importance in Biological Regulation. In: G. J. Siegel, B. W. Agranoff, R. W .Albers, & et al., editors. Basic Neurochemistry: Molecular, Cellular and Medical Aspects (6th edition). Philadelphia: Lippincott-Raven. https://www.ncbi.nlm.nih.gov/books/NBK28063/
Nichols D. E. (2016). Psychedelics. Pharmacological reviews, 68(2), pp. 264–355. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4813425/
Nichols, D. E. (2022). Entactogens: How the Name for a Novel Class of Psychoactive Agents Originated. Frontiers in psychiatry, 13. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8990025/
Nishi, A., Kuroiwa, M., & Shuto, T. (2011). Mechanisms for the modulation of dopamine D(1) receptor signaling in striatal neurons. Frontiers in neuroanatomy, 5, pp. 43. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3140648/
Niu, J., Straubinger, R. M., & Mager, D. E. (2019). Pharmacodynamic Drug-Drug Interactions. Clinical pharmacology and therapeutics, 105(6), pp. 1395–1406. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6529235/
Novak, G., & Seeman, M. V. (2022). Dopamine, Psychosis, and Symptom Fluctuation: A Narrative Review. Healthcare (Basel, Switzerland), 10(9), pp. 1713. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9498563/
Nummenmaa, L., & Tuominen, L. (2018). Opioid system and human emotions. British journal of pharmacology, 175(14), pp. 2737–2749. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6016642/
Oldroyd, S. H., Manek, G., & Bhardwaj, A. (2022). Pulmonary Hypertension. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing. https://www.ncbi.nlm.nih.gov/books/NBK482463/
Olive, M. F., Koenig, H. N., Nannini, M. A., & Hodge, C. W. (2001). Stimulation of endorphin neurotransmission in the nucleus accumbens by ethanol, cocaine, and amphetamine. The Journal of neuroscience: the official journal of the Society for Neuroscience, 21(23). https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6763912/
Osborn, C. O., Wagener, D., & Thomas, S. (2022) Amphetamine overdose. American addiction center. https://recovery.org/amphetamine/overdose/
Palleria, C., Di Paolo, A., Giofrè, C., Caglioti, C., Leuzzi, G., Siniscalchi, A., De Sarro, G., & Gallelli, L. (2013). Pharmacokinetic drug-drug interaction and their implication in clinical management. Journal of research in medical sciences: the official journal of Isfahan University of Medical Sciences, 18(7), pp. 601–610. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3897029/
Paravati, S., Rosani, A., & Warrington, S. J. (2021). Physiology, Catecholamines. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing. https://www.ncbi.nlm.nih.gov/books/NBK507716/
Park, S. B., & Khattar, D. (2022). Tachypnea. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing. https://www.ncbi.nlm.nih.gov/books/NBK541062/
Parrott, A. C. (2004). Is Ecstasy MDMA? A review of the proportion of Ecstasy tablets containing MDMA, their dosage levels, and the changing perceptions of purity. Psychopharmacology, 173(3-4), pp. 234-241. https://www.researchgate.net/publication/8677803_Is_Ecstasy_MDMA_A_review_of_the_proportion_of_Ecstasy_tablets_containing_MDMA_their_dosage_levels_and_the_changing_perceptions_of_purity
Patel, R. H., & Mohiuddin, S. S. (2022). Biochemistry, Histamine. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing. https://www.ncbi.nlm.nih.gov/books/NBK557790/
Patra, C., Foster, K., Corley, J. E., & et al. (2021). Biochemistry, cAMP. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing. https://www.ncbi.nlm.nih.gov/books/NBK535431/
Pei, Y., Asif-Malik, A., & Canales, J. J. (2016). Trace Amines and the Trace Amine-Associated Receptor 1: Pharmacology, Neurochemistry, and Clinical Implications. Frontiers in neuroscience, 10, pp. 148. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4820462/
Pollard, C. B., & Young, D. C. (1951). The mechanism of the Leuckart reaction. Journal of Organic Chemistry, 16(5), pp. 661-672. https://pubs.acs.org/doi/abs/10.1021/jo01145a001
Price, G., & Patel, D. A. (2022). Drug Bioavailability. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing. https://www.ncbi.nlm.nih.gov/books/NBK557852/?report=classic
Psychonautwiki. (2022) Amphetamine. https://psychonautwiki.org/wiki/Amphetamine
Psychonautwiki. (2022). Methamphetamine. https://psychonautwiki.org/wiki/Methamphetamine
Ramamoorthy, S., Shippenberg, T. S., & Jayanthi, L. D. (2011). Regulation of monoamine transporters: Role of transporter phosphorylation. Pharmacology & therapeutics, 129(2), pp. 220–238. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3031138/
Rasmussen, N. (2006). Making the First Anti-Depressant: Amphetamine in American Medicine, 1929-1950. Journal of the History of Medicine and Allied Sciences, 61(3), pp. 288-323. https://www.researchgate.net/publication/7284074_Making_the_First_Anti-Depressant_Amphetamine_in_American_Medicine_1929-1950
Rasmussen, N. (2008). America’s first amphetamine epidemic 1929-1971: a quantitative and qualitative retrospective with implications for the present. American journal of public health, 98(6), pp. 974–985. https://doi.org/10.2105/AJPH.2007.110593
Rasmussen, N. (2011). Medical Science and the Military: The Allies’ Use of Amphetamine during World War II. The Journal of Interdisciplinary History, 42(2), pp. 205–233. https://direct.mit.edu/jinh/article-abstract/42/2/205/50354/Medical-Science-and-the-Military-The-Allies-Use-of?redirectedFrom=fulltext
Rasmussen, N. (2015). Amphetamine-Type Stimulants: The Early History of Their Medical and Non-Medical Uses. International Review of Neurobiology, 120, pp. 9-25. https://www.sciencedirect.com/science/article/abs/pii/S0074774215000045?via%3Dihub
Revel, F. G., Moreau, J. L., Gainetdinov, R. R., Bradaia, A., Sotnikova, T. D., Mory, R., Durkin, S., Zbinden, K. G., Norcross, R., Meyer, C. A., Metzler, V., Chaboz, S., Ozmen, L., Trube, G., Pouzet, B., Bettler, B., Caron, M. G., Wettstein, J. G., & Hoener, M. C. (2011). TAAR1 activation modulates monoaminergic neurotransmission, preventing hyperdopaminergic and hypoglutamatergic activity. Proceedings of the National Academy of Sciences of the United States of America, 108(20), pp. 8485–8490. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3101002/
Reyes-Parada, M., Iturriaga-Vasquez, P., & Cassels, B. K. (2020). Amphetamine Derivatives as Monoamine Oxidase Inhibitors. Frontiers in pharmacology, 10, pp. 1590. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6989591/
Rigoni, R., Breeksema, J., & Woods, S. (2022). Speed Limits: Harm Reduction for People who Use Stimulants. https://www.gpdpd.org/fileadmin/user_upload/mainline_report_complete.pdf
Richard, D. M., Dawes, M. A., Mathias, C. W., Acheson, A., Hill-Kapturczak, N., & Dougherty, D. M. (2009). L-Tryptophan: Basic Metabolic Functions, Behavioral Research and Therapeutic Indications. International journal of tryptophan research: IJTR, 2, pp. 45–60. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2908021/
Richards. J. R., & Laurin, E. G. (2022). Cocaine. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing. https://www.ncbi.nlm.nih.gov/books/NBK430769/?report=classic
Riviere, J. E., & Papich, M. G. (2009). Veterinary Pharmacology and Therapeutics. John Wiley & Sons, pp. 1309. https://books.google.cz/books?id=ievLulSqwBAC&pg=PA1309&redir_esc=y#v=onepage&q&f=false
Robertson, S. D., Matthies, H. J., & Galli, A. (2009). A closer look at amphetamine-induced reverse transport and trafficking of the dopamine and norepinephrine transporters. Molecular neurobiology, 39(2), pp. 73–80. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2729543/
Rothman, R. B., Vu, N., Partilla, J. S., Roth, B. L., Hufeisen, S. J., Compton-Toth, B. A., Birkes, J., Young, R., & Glennon, R. A. (2003). In vitro characterization of ephedrine-related stereoisomers at biogenic amine transporters and the receptorome reveals selective actions as norepinephrine transporter substrates. Journal of Pharmacology and experimental research, 307(1), pp. 138–145. https://jpet.aspetjournals.org/content/307/1/138
Ruffin, V. A., Salameh, A. I., Boron, W. F., & Parker, M. D. (2014). Intracellular pH regulation by acid-base transporters in mammalian neurons. Frontiers in physiology, 5, pp. 43. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3923155/
Sansone, R. A., & Sansone, L. A. (2014). Serotonin norepinephrine reuptake inhibitors: a pharmacological comparison. Innovations in clinical neuroscience, 11(3-4), pp. 37–42. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4008300/
Santagati, N. A., Ferrara, G., Marrazzo, A., & Ronsisvalle, G. (2002). Simultaneous determination of amphetamine and one of its metabolites by HPLC with electrochemical detection. Journal of Pharmaceutical and Biomedical Analysis, 30(2), pp. 247–255. https://pubmed.ncbi.nlm.nih.gov/12191709/
Sassone-Corsi, P. (2012). The cyclic AMP pathway. Cold Spring Harbor perspectives in biology, 4(12). https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3504441/
Sato, A. (2008). Methamphetamine use in Japan after the Second World War. Contemporary Drugs Problems, 35(4). https://www.researchgate.net/publication/305681670_Methamphetamine_use_in_Japan_after_the_Second_World_War
Seeman, P. (2009). Chapter 1: Historical overview: Introduction to the dopamine receptors. In K., Neve (ed.). The Dopamine Receptors. Springer. pp. 1–22.
Serlin, D. C., Heidelbaugh, J. J., & Stoffel, J. T. (2018). Urinary Retention in Adults: Evaluation and Initial Management. American family physician, 98(8), pp. 496–503. https://www.aafp.org/pubs/afp/issues/2018/1015/p496.html
Sharma, S., Hashmi, M. F., & Bhattacharya, P. T. (2022). Hypotension. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing. https://www.ncbi.nlm.nih.gov/books/NBK499961/
Shoar, S. N, Marwaha, R., & Molla, M. (2022). Dextroamphetamine-Amphetamine. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing. https://www.ncbi.nlm.nih.gov/books/NBK507808/?report=classic
Shoptaw, S. J., Kao, U., & Ling, W. (2009). Treatment for amphetamine psychosis. The Cochrane database of systematic reviews, 2009(1). https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7004251/
Shulgin, A. T., & Shulgin, A. (2013). Pihkal: a chemical love story (First edition.). Transform Press.
Schwartz, M. D., Canales, J. J., Zucchi, R., Espinoza, S., Sukhanov, I., & Gainetdinov, R. R. (2018). Trace amine-associated receptor 1: a multimodal therapeutic target for neuropsychiatric diseases. Expert opinion on therapeutic targets, 22(6), pp. 513–526. https://pubmed.ncbi.nlm.nih.gov/29798691/
Siddiqui, W., Gupta, V., & Huecker, M. R. (2022). Agitation. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing. https://www.ncbi.nlm.nih.gov/books/NBK493153/
Simon, L. V., & Keenaghan, M. (2022). Serotonin Syndrome. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing. https://www.ncbi.nlm.nih.gov/books/NBK482377/
Simon, L.V., Hashmi, M.F., & Farrell, M.W. (2022). Hyperkalemia. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing. https://www.ncbi.nlm.nih.gov/books/NBK470284/
Sitte, H. H., & Freissmuth, M. (2015). Amphetamines, new psychoactive drugs and the monoamine transporter cycle. Trends in pharmacological sciences, 36(1), pp. 41–50. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4502921/
Sitte, H. H., & Freissmuth, M. (2009). The reverse operation of Na+/Cl−-coupled neurotransmitter transporters – why amphetamines take two to tango. Journal of Neurochemistry, 112(2), pp. 340-355. https://onlinelibrary.wiley.com/doi/full/10.1111/j.1471-4159.2009.06474.x
Snyder S. H. (2011). What dopamine does in the brain. Proceedings of the National Academy of Sciences of the United States of America, 108(47), pp. 18869–18871. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3223473/
Soldin, O. P., Chung, S. H., & Mattison, D. R. (2011). Sex differences in drug disposition. Journal of biomedicine & biotechnology, 2011. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3051160/
Sonne, J., Goyal, A., & Lopez-Ojeda, W. (2022). Dopamine. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing. https://www.ncbi.nlm.nih.gov/books/NBK535451/
Sonne, J., Reddy, V., & Beato, M. R. (2021). Neuroanatomy, Substantia Nigra. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing. https://www.ncbi.nlm.nih.gov/books/NBK536995/
Sotomayor-Zárate, R., Araya, K. A., Pereira, P., Blanco, E., Quiroz, G., Pozo, S., Carreño, P., Andrés, M. E., Forray, M. I., & Gysling, K. (2010). Activation of GABA-B receptors induced by systemic amphetamine abolishes dopamine release in the rat lateral septum. Journal of neurochemistry, 114(6), pp. 1678–1686. https://onlinelibrary.wiley.com/doi/10.1111/j.1471-4159.2010.06877.x
Spencer, R. C., DeVilbiss, D. M., & Berridge, C. W. (2015). The cognitive enhancing effects of psychostimulants involve direct action in the prefrontal cortex. Biological Psychiatry, 1,77(11), pp. 940-950. https://rdw.rowan.edu/cgi/viewcontent.cgi?article=1056&context=som_facpub
Spiller, H. A., Hays, H. L., & Aleguas, A., Jr (2013). Overdose of drugs for attention-deficit hyperactivity disorder: clinical presentation, mechanisms of toxicity, and management. CNS drugs, 27(7), pp. 531–543. https://link.springer.com/article/10.1007/s40263-013-0084-8
Sprouse-Blum, A. S., Smith, G., Sugai, D., & Parsa, F. D. (2010). Understanding endorphins and their importance in pain management. Hawaii medical journal, 69(3), pp. 70–71. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3104618/
Stanley, M., Chippa, V., Aeddula, N. R., & et al. (2022). Rhabdomyolysis. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing. https://www.ncbi.nlm.nih.gov/books/NBK448168/
Starcevic, B., & Sicaja, M. (2007). Dual intoxication with diazepam and amphetamine: this drug interaction probably potentiates myocardial ischemia. Medical hypotheses, 69(2), pp. 377–380. https://pubmed.ncbi.nlm.nih.gov/17320309/
Statista. (2022). Estimated number of amphetamine users worldwide from 2010 to 2020, by region. https://www.statista.com/statistics/264741/amphetamine-users-worldwide-by-region/
Statista. (2022). Share of administration route of amphetamines use in Europe in 2020. https://www.statista.com/statistics/473387/administrationn-route-of-amphetamines-european-union-eu/
Stein, M. A., Waldman, I. D., Charney, E., Aryal, S., Sable, C., Gruber, R., & Newcorn, J. H. (2011). Dose effects and comparative effectiveness of extended release dexmethylphenidate and mixed amphetamine salts. Journal of child and adolescent psychopharmacology, 21(6), pp. 581–588. https://doi.org/10.1089/cap.2011.0018
Steinkellner, T., Yang, J. W., Montgomery, T. R., Chen, W. Q., Winkler, M. T., Sucic, S., Lubec, G., Freissmuth, M., Elgersma, Y., Sitte, H. H., & Kudlacek, O. (2012). Ca(2+)/calmodulin-dependent protein kinase IIα (αCaMKII) controls the activity of the dopamine transporter: implications for Angelman syndrome. The Journal of biological chemistry, 287(35), pp. 29627–29635. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3436163/
Stillwell, W. (2016). Membrane Transport. An Introduction to Biological Membranes, pp. 423–451. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7182109/
Sulzer, D., Cragg, S. J., & Rice, M. E. (2016). Striatal dopamine neurotransmission: regulation of release and uptake. Basal ganglia, 6(3), pp. 123–148. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4850498/
Sulzer, D., Maidment, N. T., & Rayport, S. (1993). Amphetamine and other weak bases act to promote reverse transport of dopamine in ventral midbrain neurons. Journal of neurochemistry, 60(2), pp. 527–535. https://pubmed.ncbi.nlm.nih.gov/8419534/
Sulzer, D., Sonders, M. S., Poulsen, N. W., & Galli, A. (2005). Mechanisms of neurotransmitter release by amphetamines: a review. Progress in neurobiology, 75(6), pp. 406–433. https://pubmed.ncbi.nlm.nih.gov/15955613/
S. Laban, & Saadabadi, A. (2022). Monoamine Oxidase Inhibitors (MAOI). In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing. https://www.ncbi.nlm.nih.gov/books/NBK539848/
Tadi, P., & Lui, F. (2022). Acute Stroke. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing. https://www.ncbi.nlm.nih.gov/books/NBK535369/
Tambaro, S., & Bortolato, M. (2015). Interactions of Cannabis and Amphetamine-Type Stimulants. Cannabinoid Modulation of Emotion, Memory, and Motivation, pp. 409-442. https://link.springer.com/chapter/10.1007/978-1-4939-2294-9_16#citeas
Tamura, M. (1989). Japan: stimulant epidemics past and present. https://www.unodc.org/unodc/en/data-and-analysis/bulletin/bulletin_1989-01-01_1_page007.html
Teh, L. K., & Bertilsson, L. (2012). Pharmacogenomics of CYP2D6: Molecular Genetics, Interethnic Differences and Clinical Importance. Drug Metabolism and Pharmacokinetics, 27(1), pp. 55 – 67. https://www.sciencedirect.com/science/article/abs/pii/S1347436715304626?via%3Dihub
The National Collaborating Center for Chronic Conditions (NCCCC). (2006). Symptomatic pharmacological therapy in Parkinson’s disease. Parkinson’s Disease. London: Royal College of Physicians, pp. 59–100. https://web.archive.org/web/20100827045036/http://www.nice.org.uk/nicemedia/live/10984/30087/30087.pdf
Thompson, M. R., Callaghan, P. D., Hunt, G. E., Cornish, J. L., & McGregor, I. S. (2007). A role for oxytocin and 5-HT(1A) receptors in the prosocial effects of 3,4 methylenedioxymethamphetamine (“ecstasy”). Neuroscience, 146(2), pp. 509–514. https://pubmed.ncbi.nlm.nih.gov/17383105/
Toxic Exposome Database (TED) (2022). Amphetamine (T3D2706). http://www.t3db.ca/toxins/T3D2706
Tritsch, N. X., Ding, J. B., & Sabatini, B. L. (2012). Dopaminergic neurons inhibit striatal output through non-canonical release of GABA. Nature, 490(7419), pp. 262–266. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3944587/
Trujillo, K. A., Smith, M. L., & Guaderrama, M. (2011). Powerful Behavioral Interactions Between Methamphetamine and Morphine. Pharmacology Biochemistry and Behavior, 99(3), pp.451-458. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3197716/
Tully, K., & Bolshakov, V. Y. (2010). Emotional enhancement of memory: how norepinephrine enables synaptic plasticity. Molecular brain, 3, pp. 15. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2877027/
Underhill, S. M., Wheeler, D. S., Li, M., Watts, S. D., Ingram, S. L., & Amara, S. G. (2014). Amphetamine modulates excitatory neurotransmission through endocytosis of the glutamate transporter EAAT3 in dopamine neurons. Neuron, 83(2), pp. 404–416. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4159050/
United Nations – Organizace Spojených Národů (OSN). (1996). Amphetamine-type stimulants: A global review. https://www.unodc.org/pdf/technical_series_1996-01-01_1.pdf
United Nations – Organizace Spojených Národů (OSN). (2001) World drug report. https://www.unodc.org/pdf/report_2001-06-26_1/cons_ats.pdf
United Nations – Organizace Spojených Národů (OSN). (2018). Annual prevalence of use of drugs, by region and globally, 2016. United Nations Office on Drugs and Crime. 2018. https://dataunodc.un.org/drugs/prevalence_regional
United Nations – Organizace Spojených Národů (OSN). (2022). Convention on Psychotropic Substances. https://search.un.org/results.php?query=%20Convention%20on%20Psychotropic%20Substances&fq=url%3A%28%22treaties.un.org%22%29&LtpaToken=b7mLRVDEmWbZCPwMSHW9UChjrzv8xDjUoxbAIsCiIW+KpsZF1El04LWr4AvkuVg5f+zPWPYYd+YKsmqdpwn5V%2F0KDzqotLfvHnLqLlRDfwDsNkMTMRJrh51m%2FyOFCoxOFbAxd6dUE3a2GncAvRAvJ1tzA7jG2rFEuX1DAv+h2XVaMoRhOKr3he0Q27bsrz30Of8eWiqSC1Niz5uKRhygWex9ZGk1Jsa1xyCTi5S6oVzE14F5%2FFhI6wHMa4XSiGtiElp3pqUAw%2F879nwnIET8W6d5nbamnWud6lTAXv2cVjHROynmWk08K8MgzZj1UFiq+Rs57mR3tEfQcQWTSjBzZw%3D%3D&lang=en&tpl=custom&page=1&tpl=dist_search
United Nations Office on Drugs and Crime. United Nations (UNODC). (2006).Recommended methods of the identification and analysis of amphetamine, methamphetamine, and their ring-substituted analogues in seized materials (PDF). https://www.unodc.org/pdf/scientific/stnar34.pdf
United States Food and Drug Administration (FDA). (2013). Adderall XR Prescribing Information(PDF). Shire US Inc, 1, pp. 12–13. https://www.accessdata.fda.gov/drugsatfda_docs/label/2013/021303s026lbl.pdf
United States National Library of Medicine (NLM). (2017) Metabolism and Pharmacokinetics of Amphetamine. https://web.archive.org/web/20171002194327/https://toxnet.nlm.nih.gov/cgi-bin/sis/search2/cgi-bin/sis/search2/f?.%2Ftemp%2F~mdjW95%3A1%3AFULL
Vanhoutte, P. M. (1987). Serotonin and the vascular wall. International Journal of Cardiology, 14(2), pp. 189–203. https://www.internationaljournalofcardiology.com/article/0167-5273(87)90008-8/pdf
Vasan, S., & Olango, G. J. (2022). Amphetamine Toxicity. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing. https://www.ncbi.nlm.nih.gov/books/NBK470276/
Vaughan, R. A., & Foster, J. D. (2013). Mechanisms of dopamine transporter regulation in normal and disease states. Trends in pharmacological sciences, 34(9), pp. 489–496. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3831354/
Vidya, P., Gross, A., Polasek, T., Qin, Y., Rao, G., Forrest, A., Xu, J., & Mclachlan A. (2013). Considering CYP1A2 phenotype and genotype for optimizing the dose of olanzapine in Schizophrenia. Expert opinion on drug metabolism & toxicology 1(1). https://www.researchgate.net/publication/236635845_Considering_CYP1A2_phenotype_and_genotype_for_optimizing_the_dose_of_olanzapine_in_Schizophrenia
Vo, K., Neafsey, P. J., & Lin, C. A. (2015). Concurrent use of amphetamine stimulants and antidepressants by undergraduate students. Patient preference and adherence, 9, pp. 161–172. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4309786/
Volkow, N. D., Koob, G. F., & McLellan, A. T. (2016). Neurobiological Advances from the Brain Disease Model of Addiction. The New England journal of medicine, 374(4), pp. 363–371. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6135257/
Wang, B., Yang, L., Zhang, X., Huang, S., Bartlam, M., & Zhou, S. (2009). New insights into the structural characteristics and functional relevance of the human cytochrome P450 2D6 enzyme. Drug Metabolism Reviews, 41(4), pp. 573-643. https://www.tandfonline.com/doi/abs/10.1080/03602530903118729?journalCode=idmr20
Wang, C., Liu, S., Latham, L.E., & Liu F. (2022). Phencyclidine (PCP)-induced neurotoxicity and behavioral deficits. Advances in Neurotoxicology. https://www.sciencedirect.com/science/article/abs/pii/S2468748022000054?via%3Dihub
Wang, R., & Reddy, P. H. (2017). Role of Glutamate and NMDA Receptors in Alzheimer’s Disease. Journal of Alzheimer’s disease: JAD, 57(4), pp. 1041–1048. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5791143/
Wasserman, D. D., Creech, J. A., & Healy, M. (2021). Cooling Techniques for Hyperthermia. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing. https://www.ncbi.nlm.nih.gov/books/NBK459311/
Weisler R. H. (2005). Safety, efficacy and extended duration of action of mixed amphetamine salts extended-release capsules for the treatment of ADHD. Expert opinion on pharmacotherapy, 6(6), pp. 1003–1017. https://doi.org/10.1517/14656566.6.6.1003
White, B. C., Haswell, K. L., Kassab, C. D., Harkins, D., Jr, & Crumbie, P. M. (1984). Caffeine reduces amphetamine-induced activity in asymmetrical interaction. Pharmacology, biochemistry, and behavior, 20(3), pp. 387–389. https://pubmed.ncbi.nlm.nih.gov/6709674/#:~:text=A%20cross%2Dtolerance%20design%20revealed,affect%20subsequent%20caffeine%2Dinduced%20activity
Wilcox J. (2012). Psychoactive properties of alpha-methyltryptamine: analysis from self reports of users. Journal of psychoactive drugs, 44(3), pp. 274–276. https://pubmed.ncbi.nlm.nih.gov/23061328/
Wilson, A. (2008). Mixing the Medicine:The unintended consequence of amphetamine control on the Northern SoulScene. Internet Journal of Criminology. https://web.archive.org/web/20110713045851/http://www.internetjournalofcriminology.com/Wilson%20-%20Mixing%20the%20Medicine.pdf
Winstanley, C. A., Theobald, D. E., Dalley, J. W., & Robbins, T. W. (2005). Interactions between serotonin and dopamine in the control of impulsive choice in rats: therapeutic implications for impulse control disorders. Neuropsychopharmacology: official publication of the American College of Neuropsychopharmacology, 30(4), pp. 669–682. https://pubmed.ncbi.nlm.nih.gov/15688093/
Wise, R. A., & Robble, M. A. (2020). Dopamine and Addiction. Annual Review of Psychology, 71, pp. 79-106. https://www.annualreviews.org/doi/10.1146/annurev-psych-010418-103337
Wright, D. F., Winter, H. R., & Duffull, S. B. (2011). Understanding the time course of pharmacological effect: a PKPD approach. British journal of clinical pharmacology, 71(6), pp. 815–823. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3099368/
Young S. N. (2007). How to increase serotonin in the human brain without drugs. Journal of psychiatry & neuroscience: JPN, 32(6), pp. 394–399. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2077351/
Young, R., & Glennon, R. A. (2000). Stimulus effects of phenylpropanolamine optical isomers in (+)amphetamine-trained rats. Pharmacology, biochemistry, and behavior, 66(3), pp. 489–494. https://doi.org/10.1016/s0091-3057(00)00173-8
Zhao, L. X., Ge, Y. H., Li, J. B., Xiong, C. H., Law, P. Y., Xu, J. R., Qiu, Y., & Chen, H. Z. (2019). M1 muscarinic receptors regulate the phosphorylation of AMPA receptor subunit GluA1 via a signaling pathway linking cAMP-PKA and PI3K-Akt. FASEB journal: official publication of the Federation of American Societies for Experimental Biology, 33(5), pp. 6622–6631. https://pubmed.ncbi.nlm.nih.gov/30794430/

